Cómo los virus de la gripe entran en nuestras células: visualización en directo del proceso gracias a una nueva técnica de microscopía
Por primera vez, un equipo de científicos han logrado grabar en directo el instante en que un virus de la gripe invade una célula humana. Una nueva técnica de microscopía saca a la luz un proceso tan delicado como fascinante que nunca antes habíamos podido ver.
Por Enrique Coperías
Ilustración de una célula capturando activamente un virus de la gripe, que aparece en el centro de la imagen, en el momento inicial de su incorporación. Crédito: Emma Hyde / ETH Zurich
Para los científicos, comprender cómo empieza realmente una infección de gripe ha sido como intentar reconstruir una película entera a partir de unas pocas fotografías. Sabían cómo es el virus, qué moléculas utiliza para engancharse a la célula y cuáles participan en su entrada, pero nadie había observado en directo —y en una célula viva— la secuencia completa de su infiltración: desde que el virus toca la membrana de su objetivo hasta que queda atrapado dentro de una vesícula celular. Esta es el caballo de Troya que utiliza el agente viral para colar su material genético y demás herramientas moleculares para multiplicarse.
Ahora, un equipo de investigadores japoneses, suizos y alemanes acaba de conseguirlo. Su trabajo, publicado en la revista PNAS , ofrece la primera visualización real de los primeros minutos de la infección gripal en células vivas, gracias a una técnica de microscopía creada específicamente para no alterar las delicadísimas fuerzas que gobiernan la interacción entre el virus y la célula.
Los autores han observado algo que hasta ahora solo se podía intuir: el virus de la gripe se desliza por la superficie celular, como un explorador que busca el punto exacto donde entrar, y, cuando lo encuentra, desencadena la formación de una estructura de clatrina —una proteína estructural—y un abombamiento de la membrana que termina por engullirlo. Por primera vez, ese proceso, que dura apenas unos segundos, se ha podido seguir en tiempo real y en nanómetros de detalle.
Por qué era tan difícil ver cómo infecta el virus de la gripe
El virus de la gripe A es una esfera diminuta, de unos 90–100 nanómetros, recubierta por dos proteínas esenciales:
✅ La hemaglutinina (HA), que se agarra al ácido siálico de la superficie celular.
✅ La neuraminidasa (NA), que corta esas mismas moléculas.
Este tándem, lejos de ser contradictorio, es lo que permite que el virus camine —sí, literalmente se desplace— por la superficie de la célula.
Un solo enlace HA-ácido siálico es débil, pero el virus dispone de cientos de hemaglutininas capaces de unirse a cientos de ácidos siálicos. Aun así, las fuerzas involucradas son tan pequeñas que, hasta ahora, cualquier intento de observar el fenómeno acababa en fracaso. Para la ciencia, era como intentar filmar una pompa de jabón sin tocarla.
«Los enlaces entre las hemaglutininas y los ácidos siálicos están en el rango de 10 a 25 piconewtons», explican los autores en el artículo. Recordemos que un piconewton es una unidad de fuerza equivalente a una billonésima parte de un newton. Cualquier microscopio que ejerza fuerzas superiores a dicha cifra rompe el vínculo y altera el movimiento natural del virus.
La tecnología que lo ha hecho posible: ViViD-AFM
La microscopía de fuerza atómica (AFM) es capaz de ver estructuras nanométricas recorriendo su superficie con una punta microscópica. Pero esa punta ejerce presión. Así es como surgió la siguiente pregunta: ¿y si pudiéramos diseñar una punta tan extraordinariamente flexible que apenas tocara la célula?
Los investigadores se pusieron manos a la obra y crearon un cantiléver ultrafino, una especie de muelle microscópico con un 60% menos de rigidez que los usados habitualmente. Esto redujo la fuerza aplicada a solo 10 piconewtons, justo en el umbral de los enlaces entre el virus y la célula.
Con esa innovación nació virus-view AFM, la herramienta que por fin permitía observar el baile virus-célula sin arruinarlo. Y al combinarla con un microscopio confocal capaz de registrar fluorescencia, el equipo desarrolló un sistema híbrido llamado ViViD-AFM, que superpone en tiempo real la forma de la membrana y la posición del virus etiquetado con un tinte luminoso.
Este matrimonio entre topografía y fluorescencia ha abierto una posibilidad inédita: mirar, casi como en una película, cómo un virus de la gripe se comporta sobre la superficie de una célula viva.
🗣️ «La infección de las células de nuestro cuerpo es como una danza entre el virus y la célula», afirma Yohei Yamauchi, profesor de Medicina Molecular en la ETH Zurich, en Suiza, y líder del estudio.
Por primera vez, investigadores han observado en vivo y en alta resolución cómo los virus de la gripe infectan las células vivas. Esto fue posible gracias a una nueva técnica de microscopía, que ahora podría ayudar a desarrollar terapias antivirales más específicas.
El virus se desplaza por la superficie como si buscara la puerta correcta
Lo primero que observaron los investigadores fue que los virus no permanecen quietos una vez se unen a la membrana. Se desplazan lateralmente durante minutos, describiendo trayectorias que reflejan la heterogeneidad de la superficie celular. En los experimentos, algunas partículas avanzaron más de 1.500 segundos antes de colarse en el interior de la célula huésped, y sus velocidades fluctuaron según las zonas por las que pasaban.
El ácido siálico no está distribuido de manera uniforme y, según la densidad local, el virus se mueve más rápido o más lento. En regiones con menos ácido siálico, va suelto; en zonas más densas, se frena. El equipo midió los coeficientes de difusión individuales —una especie de velocidad efectiva— y confirmó que las variaciones pueden explicarse por la diversidad de microdominios en la membrana.
De hecho, al tratar a las células con sialidasa, una enzima que elimina ácido siálico, el virus se movía significativamente más rápido. Al bloquear la neuraminidasa con oseltamivir (Tamiflu) —un profármaco antiviral selectivo contra el virus de la gripe— se movía más lento. Ambas observaciones encajan con lo que ya se sabía: la hemaglutinina actúa como un lubricante que evita que el virus se quede pegado al primer punto de unión fuerte que encuentra.
Incluso comprobaron que dos subtipos gripales comunes —el H1N1 y el H3N2— tienen movilidades distintas, lo que sugiere que cada combinación hemaglutinina/neuraminidasa imprime al virus un «estilo de movimiento» propio que podría influir en su capacidad de infección.
El momento decisivo: el virus gripal llama a la clatrina antes de entrar
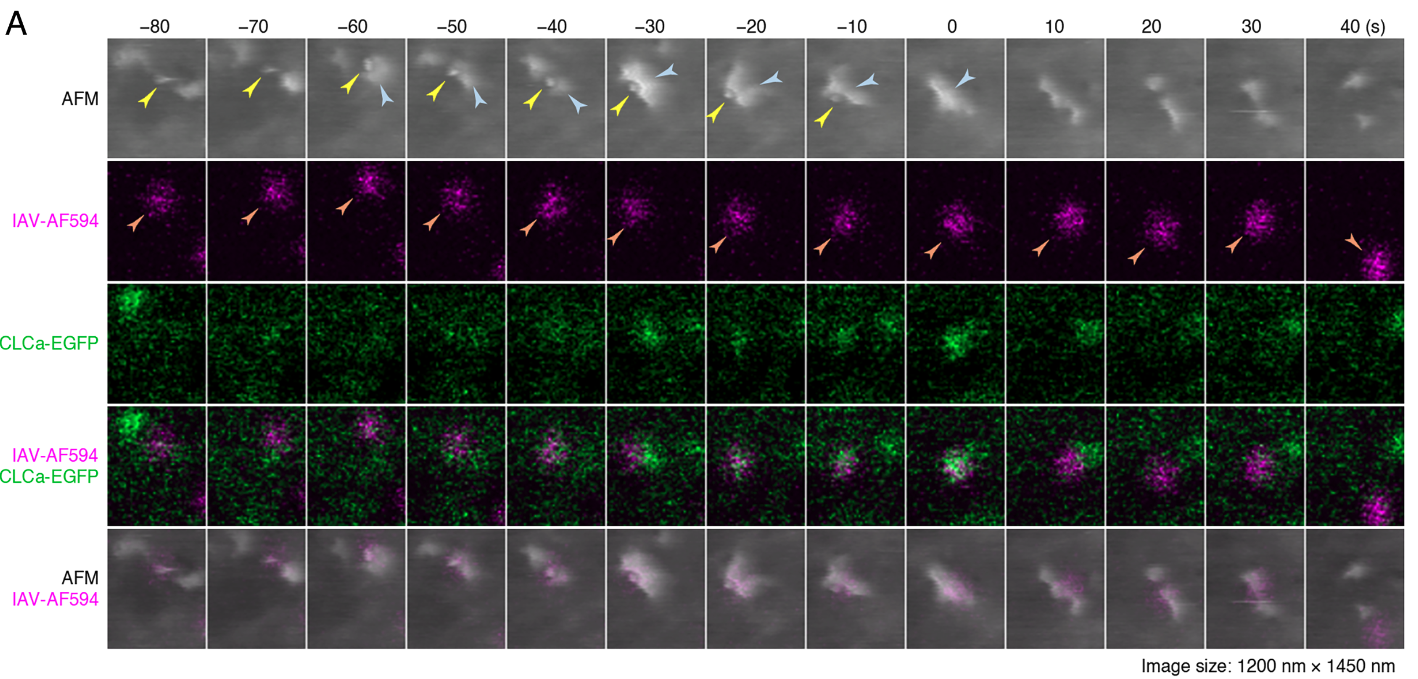
Después de moverse durante varios segundos o minutos, algunos virus comenzaban a mostrar un patrón distinto. Justo debajo del punto donde estaban anclados, empezaba a acumularse la citada clatrina, una proteína esencial para la endocitosis. Esta es el proceso por el que una célula introduce hacia su interior sustancias que están fuera de ella, envolviéndolas con su membrana hasta formar una vesícula que queda dentro de la célula. Es, básicamente, la manera en que la célula ingiere partículas, nutrientes o virus.
El microscopio confocal mostraba cómo la señal verde de la clatrina aumentaba, mientras el de fuerza atómica revelaba un cambio en la forma de la membrana. «El inicio del ensamblaje de clatrina coincidió con una caída abrupta en el movimiento del virus», señalan los autores. Ese descenso de movilidad indica que el virus queda atrapado en un pozo membranoso: la célula empieza a construir una vesícula para tragarlo.
Lo fascinante es que este ensamblaje no ocurre solo: viene acompañado de un fenómeno que hasta ahora no se había observado con claridad.
Un bulto de actina empuja a la célula a tragarse el virus
La secuencia clave, filmada por primera vez, muestra cómo la membrana celular genera un abombamiento rico en actina justo al lado del punto donde el virus va a ser engullido. Este bulto, de unos 100 nm, actúa como una compuerta: se eleva, se inclina y empuja la zona de la invaginación hacia arriba, envolviendo al virus.
Las imágenes del microscopio de fuerza atómica revela cómo el virus va perdiendo altura aparente —hundimiento en la membrana— mientras el bulto crece. La clatrina alcanza su intensidad máxima cuando el virus desaparece de la topografía, es decir, cuando la vesícula se cierra.
Aún más revelador: cuando el mismo proceso ocurre en una endocitosis normal, sin virus, el bulto es mucho más pequeño. La presencia del virus duplica su tamaño medio, lo que indica que la célula debe emplear más fuerza para envolver un objeto de la dimensión del virus de la gripe A.
Los investigadores concluyen que esta deformación está impulsada por actina y no por mecanismos alternativos como la macropinocitosis: incluso inhibiendo esta última, el bulto seguía formándose en infecciones gripales .
Durante la entrada del virus de la gripe en la célula, la membrana forma un abultamiento que acaba envolviendo al virión. La secuencia, captada con una nueva técnica de microscopía, muestra cómo el virus desaparece dentro de la célula en cuestión de segundos. Cortesía: A. Yoshida, Y. Uekusa, T. Suzuki, M. Bauer, N. Sakai & Y. Yamauchi
Por qué este avance importa: aplicaciones prácticas
Este trabajo no solo permite entender mejor cómo la gripe entra en nuestras células; también abre la puerta a aplicar la ViViD-AFM a una nueva generación de estudios. Por ejemplo, con esta técnica se puede:
✅ Medir cómo cambios específicos en la hemaglutinina y la neuraminidasa modifican la capacidad de movimiento del virus.
✅ Evaluar en tiempo real fármacos que bloquean la entrada viral.
✅ Estudiar por qué algunas variantes se internalizan antes que otras.
✅ Analizar nanopartículas terapéuticas (como las de vacunas ARNm) y cómo difunden por la membrana.
✅ Investigar cómo bacterias o vesículas extracelulares interactúan con la superficie celular.
Pocas tecnologías permiten observar algo tan delicado sin interferir en ello, advierte Yamauchi. Y la entrada viral es especialmente vulnerable: muchas veces, una mutación que altera mínimamente la adhesión o movilidad del virus puede aumentar o reducir enormemente su infectividad. ViViD-AFM permite ver esas diferencias en acción.
La infección gripal ya no es invisible
La investigación logra lo que durante años parecía imposible: convertir en secuencia visible lo que antes eran conjeturas y modelos estáticos. Ahora sabemos que el virus de la gripe no entra simplemente a la fuerza, sino que explora, frena, recluta ayuda y empuja a la célula a construir una estructura compleja para engullirlo.
Lo que ocurre en apenas 30 o 60 segundos —y en un espacio miles de veces más pequeño que el grosor de un cabello— ha quedado por fin registrado.
La infección gripal, con todo su impacto sanitario global, empieza con un simple viaje de superficie. Ahora podemos verlo. Y entender ese primer paso, tan frágil como decisivo, nos acerca un poco más a la posibilidad de impedirlo.▪️
Información facilitada por la ETH Zurich
Fuente: A. Yoshida, Y. Uekusa, T. Suzuki, M. Bauer, N. Sakai & Y. Yamauchi. Enhanced visualization of influenza A virus entry into living cells using virus-view atomic force microscopy. PNAS (2025). DOI: https://doi.org/10.1073/pnas.2500660122