El primer «pulmón en un chip» que respira: así se recrean los alvéolos humanos con células genéticamente idénticas
Un modelo tridimensional creado a partir de células madre humanas permite estudiar la tuberculosis y otras enfermedades respiratorias sin necesidad de recurrir a animales de laboratorio.
Por Enrique Coperías
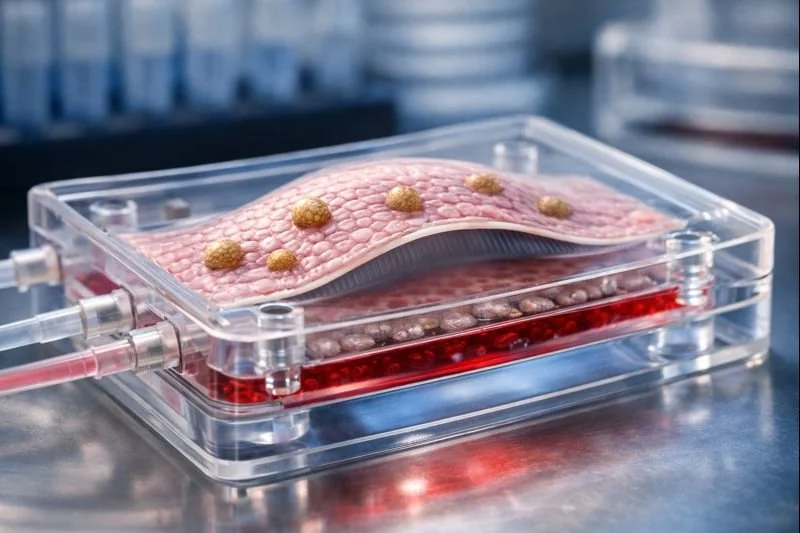
Imagen conceptual de un pulmón en un chip, que recrea los alvéolos humanos mediante células madre genéticamente idénticas y una membrana flexible que simula la respiración. Crédito: IA-DALL-E-©RexMolón Producciones
Los investigadores llevan años tratando de reproducir el pulmón humano en el laboratorio con una fidelidad suficiente como para estudiar enfermedades respiratorias sin tener que echar mano de modelos animales. El desafío no es menor: el pulmón no es solo un conjunto de células, sino un tejido vivo sometido a movimientos constantes, atravesado por vasos sanguíneos y vigilado por un sofisticado sistema inmunitario.
Ahora, un equipo internacional de científicos liderado desde el Instituto Francis Crick de Londres (Reino Unido) ha dado un paso decisivo con el desarrollo del primer pulmón en un chip capaz de respirar y construido íntegramente a partir de células humanas genéticamente idénticas.
El avance, publicado en la revista Science Advances, no es simplemente una mejora técnica de lo que había hasta ahora. Supone un cambio conceptual en la manera de estudiar las enfermedades pulmonares como la tuberculosis, una de las infecciones más mortales del planeta, causada por la bacteria Mycobacterium tuberculosis, y abre la puerta a modelos experimentales más precisos, reproducibles y éticamente sostenibles.
Qué es un «órgano en un chip»
Los llamados órganos en chip son dispositivos microfluídicos del tamaño de una tarjeta de memoria que recrean, en tres dimensiones, la arquitectura y el funcionamiento básico de órganos humanos.
Los llamados órganos en un chip son dispositivos microfluídicos del tamaño de una tarjeta de memoria que recrean, en tres dimensiones, la arquitectura y el funcionamiento básico de órganos humanos. Esta tecnología comenzó a gestarse a principios de la década de 2010, impulsada por la convergencia entre la ingeniería biomédica, la microfabricación y la biología celular, con el objetivo de superar las limitaciones de los cultivos planos y de los modelos animales.
Desde entonces, los órganos en un chip han evolucionado desde sistemas simples de una sola capa celular hasta plataformas cada vez más complejas que integran múltiples tipos celulares, flujos de fluidos, señales mecánicas y respuestas inmunológicas. En la actualidad, existen modelos experimentales de intestino, hígado, riñón, cerebro y pulmón, entre otros, y varios de ellos ya se utilizan para evaluar la toxicidad de fármacos y los mecanismos de ciertas enfermedades.
Sin embargo, la mayoría sigue enfrentándose a un reto nda desdeñable: reproducir de forma estable y realista la interacción entre tejidos, vasos sanguíneos y sistema inmune, un desafío que marca la frontera actual de esta tecnología emergente.
Un pulmón en miniatura que se mueve y respira
En el caso del pulmón, el reto radica en imitar los alvéolos, los diminutos sacos donde se produce el intercambio de oxígeno y dióxido de carbono, y hacerlo bajo condiciones realistas de estiramiento mecánico, como las que provoca la respiración.
El nuevo sistema, bautizado como iLoC (iPSC-derived lung-on-chip), logra ese objetivo mediante una membrana flexible que se expande y contrae rítmicamente, simulando el acto de respirar. Sobre esa membrana se organizan cuatro tipos celulares clave del alvéolo humano:
✅ Células epiteliales alveolares tipo I.
✅ Células epiteliales alveolares tipo II.
✅ Células endoteliales vasculares.
✅ Macrófagos, las células inmunitarias residentes que patrullan los pulmones.
La gran innovación es que todas estas células proceden de una única fuente: células madre pluripotentes inducidas (iPSC) derivadas de un solo donante. Esto significa que son genéticamente idénticas, un detalle técnico que tiene enormes implicaciones científicas.
El valor de la identidad genética
En los modelos tradicionales, las distintas células suelen proceder de donantes diferentes o de líneas celulares establecidas hace décadas. Esa mezcla introduce una variabilidad genética difícil de controlar, que complica la interpretación de los resultados.
En el iLoC, en cambio, todas las células comparten el mismo genoma humano, lo que permite atribuir los cambios observados a procesos biológicos reales y no a diferencias genéticas de partida, según Chak Hon Luk, autor principal del estudio e investigador dl Laboratorio de Tuberculosis en el Instituto Francis Crick.
Además, las iPSC pueden modificarse genéticamente con precisión mediante herramientas como la CRISPR —herramienta de edición genética que permite cortar y modificar el ADN con gran precisión, como si fueran tijeras moleculares, para activar, desactivar o corregir genes específicos—, lo que convierte al pulmón en un chip en un sistema genéticamente tratable, capaz de responder a preguntas muy específicas sobre el papel de determinados genes en la salud pulmonar y la enfermedad respiratoria.
«El objetivo era crear un modelo humano completo y accesible, que reprodujera no solo la estructura del alvéolo, sino también su comportamiento inmunológico», explican los autores del estudio. Para comprobarlo, sometieron el sistema a una de las pruebas más exigentes: la infección con Mycobacterium tuberculosis, la bacteria responsable de la tuberculosis.
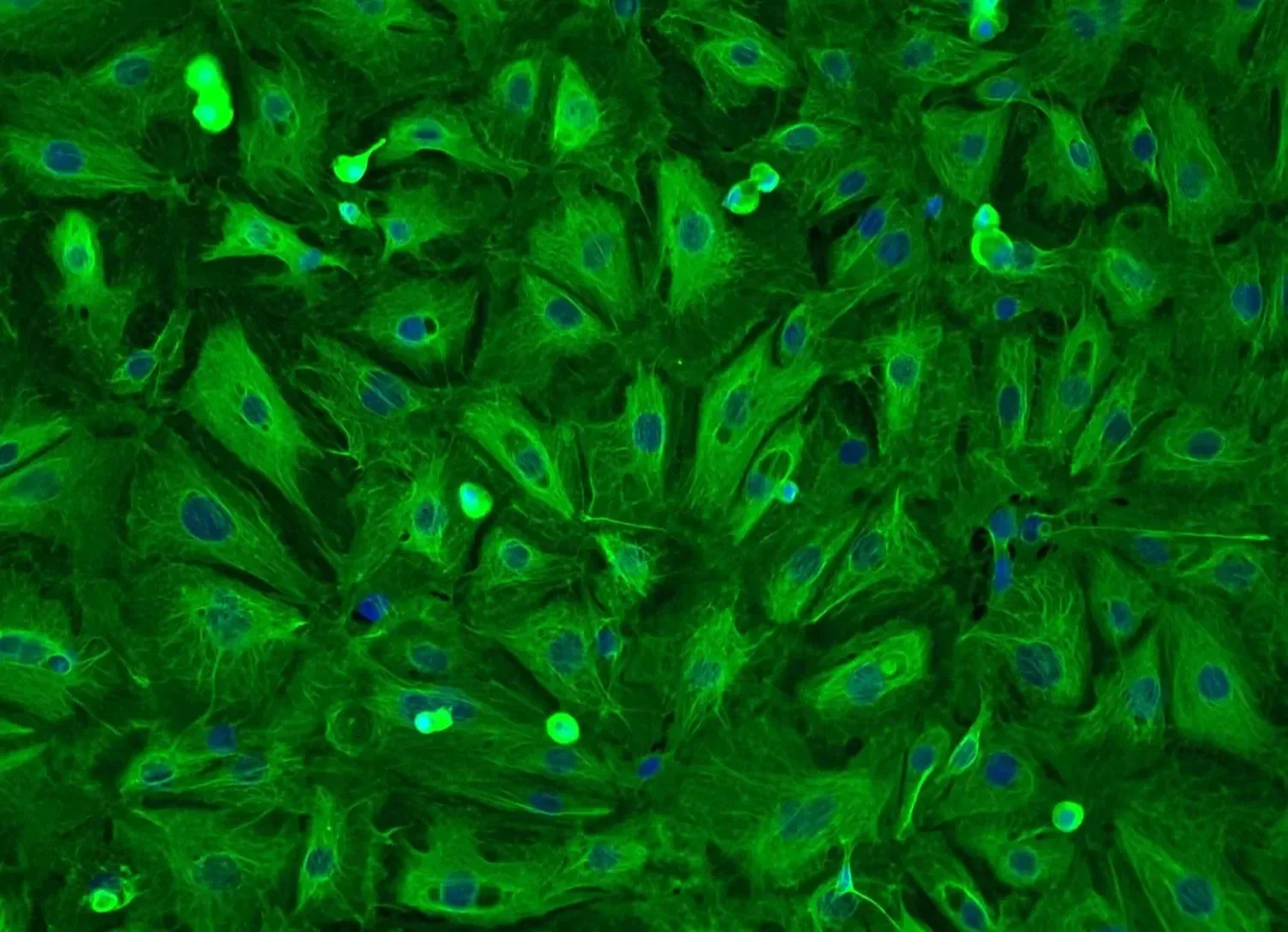
Células epiteliales alveolares humanas adultas. Cortesía: ScienceCell Research Labpratories
Tuberculosis en tiempo real
La tuberculosis sigue causando más de un millón de muertes al año, a pesar de ser una enfermedad conocida desde hace siglos. Una de las razones de su persistencia es la complejidad de las primeras fases de la infección, que ocurren precisamente en los alvéolos pulmonares y son difíciles de observar directamente en humanos.
En el iLoC, los investigadores infectaron el tejido con una dosis extremadamente baja de bacterias, más cercana a lo que ocurre en una infección natural que a los modelos de laboratorio convencionales. El resultado fue revelador: tanto los macrófagos como las células epiteliales alveolares podían infectarse, pero en la mayoría de los casos no permitían que la bacteria se multiplicara de forma masiva durante las primeras 48 horas.
Este comportamiento contrasta con los cultivos celulares en 2D, donde Mycobacterium tuberculosis suele replicarse rápidamente. El hallazgo sugiere que el microambiente tridimensional del alvéolo, con su combinación de células, señales químicas y fuerzas mecánicas, ejerce un control mucho más eficaz sobre la infección pulmonar inicial.
Sin embargo, el modelo también mostró que la infección no es homogénea. De manera estocástica, aparecían focos localizados de macrófagos que se agrupaban formando estructuras con un núcleo necrótico, en las que la bacteria sí lograba replicarse. Estos microfocos recuerdan a las lesiones tempranas de la tuberculosis que se observan en el pulmón humano y podrían ser clave para entender cómo se inicia la enfermedad activa.
Cuando la defensa falla
El estudio también desvela que la muerte celular es un componente central de estas fases iniciales. En las primeras horas tras la infección, la mayoría de las células que mueren son macrófagos alveolares. Con el paso de los días, el daño se extiende al epitelio pulmonar y al endotelio, comprometiendo la integridad de la barrera alveolar.
El pulmón en un chip permite medir este deterioro con precisión mediante la resistencia eléctrica del tejido, un indicador de su función como barrera biológica. A las 48 horas, el sistema muestra signos de daño, pero mantiene su estructura. A los cinco días, la barrera colapsa, reproduciendo un escenario de inflamación pulmonar severa y destrucción tisular.
Esta capacidad para seguir la evolución temporal de la infección, célula a célula, es una de las grandes fortalezas del modelo. «Nos permite observar procesos que en humanos solo podemos inferir de forma indirecta», señalan los investigadores.
Autofagia, genética y muerte celular
Para demostrar el potencial del sistema como herramienta experimental, el equipo fue un paso más allá y creó una versión genéticamente modificada del pulmón en un chip. En este caso, inactivaron en los macrófagos un gen clave de la autofagia, el ATG14, un proceso celular esencial para la degradación de los agentes patógenos y el mantenimiento de la homeostasis celular.
El resultado fue sorprendente. Los macrófagos deficientes en el gen ATG14 no mostraron una mayor replicación bacteriana, pero sí una tasa mucho más alta de muerte celular, incluso en ausencia de infección. Durante la infección con Mycobacterium tuberculosis, esta vulnerabilidad se tradujo en un daño más temprano del endotelio pulmonar y en una alteración profunda del entorno inflamatorio alveolar.
En otras palabras, la autofagia en los macrófagos parece ser crucial no tanto para frenar directamente a la bacteria, sino para preservar la integridad del tejido pulmonar y modular la respuesta inflamatoria. Un matiz que difícilmente habría podido detectarse en modelos más simples.
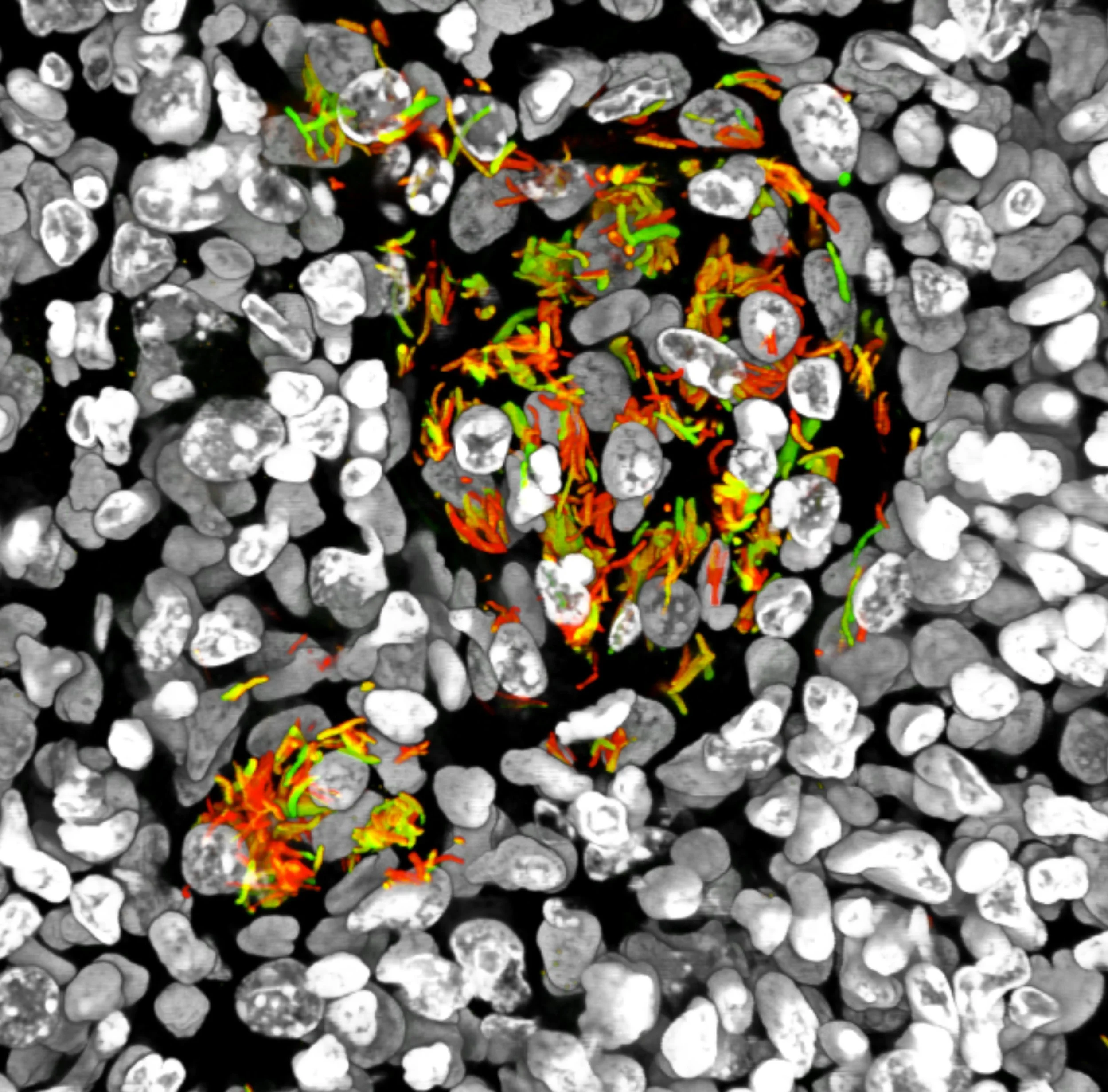
Tejido pulmonar de ratón infectado con Mycobacterium tuberculosis modificada genéticamente para emitir fluorescencia en función de la acidez y la concentración de cloruros, una técnica utilizada para estudiar el microambiente de la infección en modelos animales. Cortesía: Dr. Shumin Tan / Cornell University/ Department of Microbiology / https://www.nikonsmallworld.com
Más allá de la tuberculosis
Aunque el estudio se centra en la tuberculosis, las implicaciones del iLoC son mucho más amplias. El pulmón en un chip podría utilizarse para estudiar infecciones virales respiratorias, como la gripe y el SARS-CoV-2 —el causante de lacovid-19—; enfermedades inflamatorias crónicas; procesos de regeneración pulmonar; e incluso la toxicidad de fármacos inhalados.
Además, el uso de células humanas genéticamente idénticas responde a una demanda creciente de alternativas a la experimentación animal, en línea con los principios de reemplazo, reducción y refinamiento que promueven las agencias reguladoras.
🗣️ «Dada la creciente necesidad de tecnologías que no utilicen animales, los enfoques de órganos en chip están cobrando cada vez más importancia para recrear los sistemas humanos, evitando las diferencias en la anatomía pulmonar, la composición de las células inmunitarias y el desarrollo de enfermedades entre animales y seres humanos», explica Max Gutiérrez, director principal del Laboratorio de Interacciones Hospedador-Patógeno en Tuberculosis del Crick y coautor del trabajo.
Los propios autores reconocen que el modelo aún no es perfecto. Falta incorporar otros tipos celulares, como fibroblastos o neutrófilos, y mejorar aspectos como el flujo sanguíneo simulado. Pero también subrayan que se trata de una plataforma experimental flexible, diseñada para evolucionar.
Un laboratorio del futuro
El pulmón en chip que respira no es un simple artefacto tecnológico. Es una ventana al funcionamiento íntimo de uno de los órganos más complejos del cuerpo humano.
Al combinar ingeniería biomédica, biología celular y genética en un único sistema, este modelo anticipa una forma distinta de hacer investigación biomédica: más precisa, más humana y, paradójicamente, más cercana a la fisiología real.
En un momento en que las enfermedades respiratorias siguen siendo una amenaza global, disponer de un alvéolo humano en miniatura, capaz de enfermar y defenderse como el real, puede marcar la diferencia entre observar la enfermedad desde fuera o entenderla desde dentro.▪️
Información facilitada por el The Francis Crick Institute
Fuente: Chak Hon Luk et al. Autologous human iPSC–derived alveolus-on-chip reveals early pathological events of Mycobacterium tuberculosis infection. Science Advances (2026). DOI: 10.1126/sciadv.aea9874