El microbio con el genoma más pequeño hasta la fecha redefine y amplía los límites de la vida
Un microorganismo que viven dentro de las células de los insectos y cuyo ADN cuenta con apenas 50.000 letras se ha convertido en el ser vivo con el genoma más pequeño conocido. Su existencia obliga a replantear qué es realmente una célula y hasta dónde puede reducirse la vida sin desaparecer.
Por Enrique Coperías, periodista científico
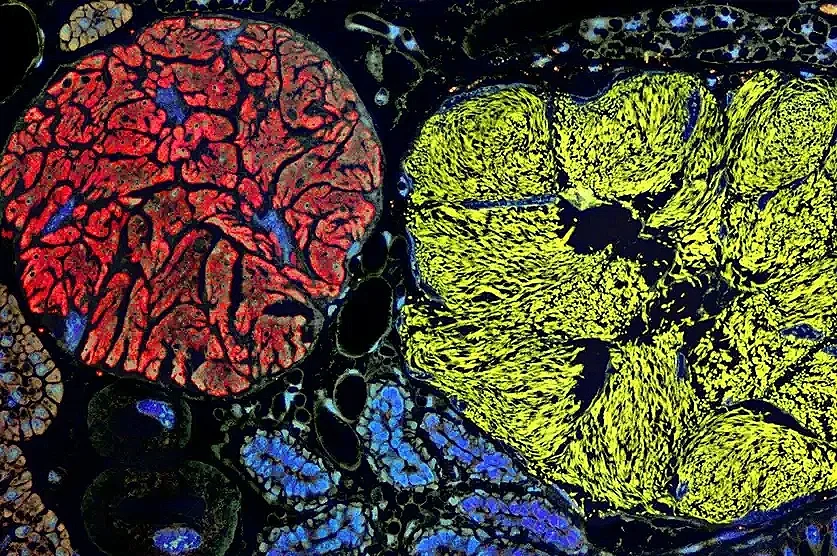
Corte transversal del insecto Callodictya krueperi: las bacterias simbióticas habitan en órganos especializados llamados bacteriomas. Las sondas fluorescentes identifican tres microbios: Vidania (rojo), Sodalis (amarillo) y Sulcia (verde). Cortesía: Anna Michalik et al.
El genoma más pequeño del que se tiene constancia no pertenece a un virus ni a un orgánulo celular, sino a una bacteria. Un nuevo estudio internacional acaba de identificar microorganismos simbióticos con apenas 50.000 letras de ADN —unas diez veces menos que el genoma bacteriano artificial mínimo diseñado en un laboratorio— que sobreviven dentro de las células de insectos y redefinen los límites de la vida celular.
El hallazgo, publicado en la revista Nature Communications, no solo marca un récord en biología evolutiva, sino que plantea preguntas profundas sobre el origen de las mitocondrias, la dependencia entre especies y la frontera difusa entre organismo independiente y orgánulo celular.
En palabras de Piotr Łukasik, biólogo de la Universidad Jaguelónica de Cracovia, en Polonia y uno de los autores del estudio, resulta muy difícil determinar dónde termina exactamente este simbionte altamente integrado en las células que coloniza y dónde comienza un orgánulo celular, como puede ser una mitocondria. «Se trata de una frontera muy difusa», dice.
Qué es el genoma más pequeño del mundo (y por qué importa)
Desde hace décadas, los biólogos saben que algunas bacterias simbióticas que viven dentro de insectos poseen genomas extraordinariamente pequeños. A lo largo de millones de años, al quedar confinadas dentro de las células de sus hospedadores, estos microbios han ido perdiendo genes que ya no necesitaban, porque el propio insecto o sus otros microorganismos se encargaban de esas funciones.
Pero el nuevo estudio demuestra que ese proceso puede llegar mucho más lejos de lo que se pensaba. Los investigadores han analizado las bacterias simbióticas de los fulgoromorfos (Fulgoromorpha) —un infraorden diverso de insectos chupadores de savia, conocidos popularmente como chicharritas— y han encontrado genomas bacterianos de apenas 50 a 52 kilobases. En otras palabras, ADN de entre 50.000 y 52.000 bases o nucleótidos en total.
Para hacerse una idea de la magnitud: la conocida bacteria intestinal Escherichia coli posee más de cuatro millones de pares de bases, mientras que el genoma artificial mínimo capaz de crecer en laboratorio ronda los 531.000. Las nuevas bacterias simbióticas son casi un orden de magnitud más pequeñas.
Con tan poco ADN, estos microorganismos conservan solo unas decenas de genes funcionales: en algunos casos, apenas 62. Es un número tan bajo que solo los orgánulos celulares, como las mitocondrias y los cloroplastos, tienen genomas comparables en tamaño.
Sobre estas líneas, un fulgoromorfo, insectos que cuentan en sus células con bacterias que poseen el récord de longitud mínima del ADN. Foto: Vuong Tran
Bacterias simbióticas, una relación de 263 millones de años
Las protagonistas de esta historia son dos bacterias ancestrales, la Sulcia y la Vidania, que viven en simbiosis obligada con los fulgoromorfos desde hace unos 263 millones de años. Se transmiten de generación en generación a través de los huevos, por lo que su evolución ha ido ligada a la de sus hospedadores.
En la mayoría de especies, estas bacterias se encargan de fabricar aminoácidos esenciales que los insectos no pueden obtener de su dieta basada en la savia vegetal, pobre en nutrientes. A cambio, los insectos les proporcionan refugio y recursos.
👉 Durante cientos de millones de años, la Sulcia y la Vidania han ido perdiendo genes poco útiles en este contexto protegido. El estudio muestra que, en general, este proceso de reducción genética es gradual y alcanza un punto de equilibrio en el que solo se conservan los genes indispensables.
Sin embargo, en algunas líneas evolutivas se ha producido una reducción mucho más drástica. En dos grupos distintos de fulgoromorfos, separados evolutivamente por cientos de millones de años, las bacterias Vidania han convergido hacia genomas ultrarreducidos casi idénticos, lo que sugiere que existe un límite funcional al tamaño mínimo que puede alcanzar un genoma bacteriano en este tipo de simbiosis.
Una bacteria que solo produce un aminoácido
En su versión más extrema, estas bacterias han reducido su función a casi un único cometido: producir fenilalanina, un aminoácido esencial para el insecto. Este compuesto es precursor de la tirosina, necesaria para formar y endurecer la cutícula de los insectos, su principal defensa frente al entorno.
El resto de funciones metabólicas han desaparecido o han sido asumidas por otros microorganismos simbióticos o por el propio insecto. Algunas especies de fulgoromorfos albergan bacterias adicionales o incluso hongos que suplen los genes perdidos por las bacterias simbiontes ancestrales.
Este reparto de tareas crea un sistema biológico altamente interdependiente, donde la supervivencia de cada miembro depende de los demás. En algunos casos, las bacterias más antiguas han perdido casi toda su autonomía y funcionan como piezas especializadas dentro de un consorcio microbiano.
Más cerca de las mitocondrias que de una bacteria libre
El nivel de dependencia que muestran estas bacterias ultrarreducidas recuerda al de las mitocondrias, los orgánulos celulares responsables de producir energía en las células eucariotas. Se cree que las mitocondrias proceden de antiguas bacterias que establecieron una relación simbiótica con las células primitivas y acabaron integrándose en ellas.
Las bacterias descritas en el estudio parecen encontrarse en un estadio intermedio de ese proceso evolutivo. Han perdido muchos genes necesarios para funciones básicas como la replicación del ADN o la síntesis de proteínas, lo que indica que dependen de proteínas producidas por el hospedador.
Por ejemplo, en algunos genomas de Vidania solo quedan entre dos y ocho genes relacionados con la replicación del ADN, frente a más de treinta en bacterias típicas como la citada E. coli. Otros componentes esenciales, como las enzimas que cargan los ARN de transferencia durante la síntesis de proteínas, también han desaparecido, lo que sugiere que son suministrados por la célula del insecto.
Esta integración funcional difumina la frontera entre bacteria y orgánulo. Aunque todavía son organismos independientes desde el punto de vista evolutivo, su funcionamiento cotidiano depende casi por completo del hospedador.
Evolución convergente hacia el mínimo
Uno de los aspectos más llamativos del estudio es que los genomas más pequeños han surgido de forma independiente en distintos linajes de insectos. A pesar de esa evolución separada, las bacterias resultantes han terminado con conjuntos de genes muy similares.
Este paralelismo sugiere que la evolución reductiva no es un proceso completamente dependiente del azar. Cuando las bacterias viven durante millones de años en un entorno estable y protegido, sometidas a fuertes presiones para eliminar funciones redundantes, su genoma puede converger hacia un mismo núcleo mínimo de genes imprescindibles.
Ese núcleo incluye genes para fabricar ribosomas —las fábricas celulares de ensamblaje de proteínas—, copiar el ADN y realizar unas pocas funciones metabólicas básicas. Todo lo demás puede perderse si el hospedador o otros simbiontes suplen las funciones correspondientes.
Según los autores del estudio, este patrón sugiere que estas bacterias han alcanzado un equilibrio evolutivo cercano al límite inferior de la complejidad celular en este sistema concreto.
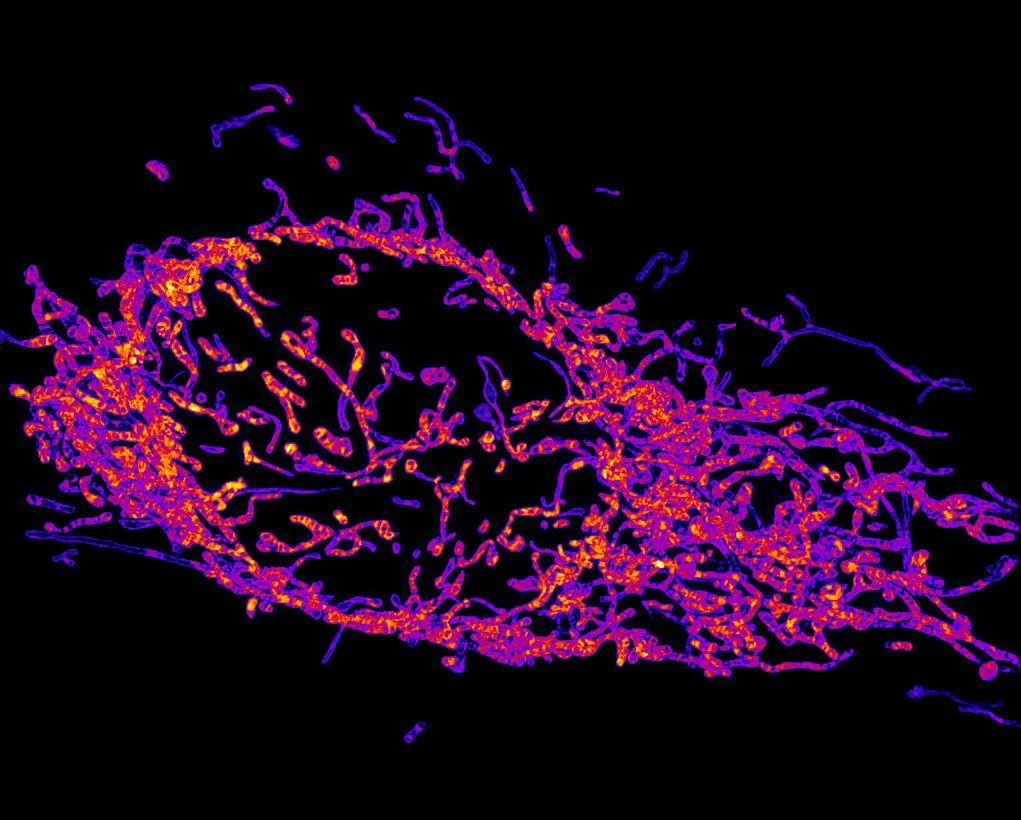
Mitocondrias en una célula cancerosa HeLa. Cortesía: Dr. Reto Paul Fiolka / The University of Texas Southwestern Medical Center / Department of Cell Biology / https://www.nikonsmallworld.com/
El papel del entorno y la dieta
El estudio también muestra que los cambios ecológicos del hospedador influyen en la reducción genética de sus simbiontes. Cuando los insectos modifican su dieta o adquieren nuevos microbios que aportan nutrientes, algunas funciones bacterianas dejan de ser necesarias y los genes asociados pueden perderse.
Por ejemplo, ciertas especies de fulgoromorfos que pasan parte de su vida alimentándose de hongos o viviendo en cuevas han experimentado cambios en sus necesidades nutricionales. En estos casos, los simbiontes ancestrales han perdido más genes, mientras que otros microbios o el propio insecto han asumido esas funciones.
Este proceso puede conducir a una espiral de dependencia mutua: a medida que el insecto depende más de sus simbiontes, estos se vuelven también más dependientes del hospedador. Los autores describen esta situación como un “agujero evolutivo” del que resulta difícil escapar.
¿Cuál es el límite de la vida celular?
El descubrimiento de estos genomas ultrarreducidos amplía la noción de lo que puede considerarse un organismo vivo independiente. Si una bacteria puede sobrevivir con apenas medio centenar de genes funcionales, la definición de célula autónoma se vuelve más flexible.
Algunos científicos sugieren que, con suficiente apoyo del hospedador, un genoma podría reducirse aún más. Los genomas mitocondriales más pequeños conocidos contienen solo unos pocos genes, lo que plantea la posibilidad de que el límite teórico de un genoma funcional sea extremadamente bajo.
El estudio abre la puerta a buscar otros microorganismos aún más reducidos en insectos y otros animales. También ofrece un modelo natural para entender cómo surgieron los orgánulos celulares y cómo la cooperación entre especies puede llevar a formas de vida profundamente interdependientes.
En última instancia, estos microbios casi invisibles obligan a replantear una cuestión fundamental: dónde termina un organismo y empieza otro. En el interior de un insecto diminuto, la evolución ha llevado esa pregunta hasta el extremo, mostrando que la vida puede persistir incluso cuando apenas queda un puñado de genes.▪️(20-febrero-2026)
Información facilitada por la Universidad Jaguelónica de Cracovia
Fuente: Michalik, A., Franco, D. C., Deng, J. et al. Convergent extreme reductive evolution in ancient planthopper symbioses. Nature Communications (2026). DOI: https://doi.org/10.1038/s41467-026-69238-x