Las células inmunitarias se convierten en «mini-Hulks» para abrirse paso por los tejidos del cuerpo
Nuestras células defensivas esconden una fuerza sorprendente: son capaces de empujar y deformar los tejidos para avanzar sin causar daño. Un estudio revela cómo lo logran: se convierten en auténticos «mini-Hulks» dentro del cuerpo humano. Estamos ante un hallazgo clave para tratar enfermedades inmunológicas, inflamatorias y oncológicas.
Por Enrique Coperías
Ilustración simpática de células inmunitarias antropomorfizadas, inspiradas en el hallazgo científico que revela cómo estas Hulks en miniatura usan su fuerza interna para empujar tejidos y abrirse paso por entornos estrechos del cuerpo sin dañarlos, gracias a una estructura central de actina clave para su migración. Imagen generada con DALL-E
En el interior de nuestro cuerpo, lejos de la vista, tiene lugar un proceso constante y vital: células inmunes patrullando a toda velocidad por laberintos tridimensionales de tejidos en busca de señales de infección, inflamación u otros peligro.
Estas células, como los linfocitos T y las células dendríticas, deben desplazarse por espacios tan estrechos que, en ocasiones, ni siquiera hay sitio para que pasen.
¿Cómo logran entonces avanzar? ¿Empujan, arrastran, se deslizan o tal vez mastican su camino? Un nuevo estudio del Instituto de Ciencia y Tecnología de Austria (ISTA), publicado en la revista Nature Immunology, ofrece una respuesta tan sorprendente como ingeniosa: estas células se comportan como el superhéroe Hulk, pero en miniatura, dando empujes internos capaces de abrir espacio entre las fibras del tejido por donde avanzan. Y lo hacen sin causar estragos ni destruir el entorno.
¿Cómo se mueven las células inmunes por el cuerpo humano?
El sistema inmune necesita de una fluida movilidad celular para cumplir su función. Las células inmunes deben viajar desde zonas periféricas, como la piel y el intestino, hasta los ganglios linfáticos, donde inician y coordinan respuestas inmunológicas. Pero este viaje implica atravesar tejidos densos y complejos, una tarea nada sencilla.
A diferencia de superficies planas, donde muchas células se estudian tradicionalmente, los tejidos del cuerpo humano son tridimensionales, variables y, a menudo, demasiado estrechos para permitir un paso libre.
«Los tejidos del cuerpo son como ciudades superpobladas, con calles que se estrechan sin previo aviso. Las células inmunes tienen que encontrar su camino sin mapa y sin semáforos», explica Patricia Reis-Rodrigues, autora principal del estudio y estudiante de doctorado en el laboratorio de Michael Sixt en ISTA.
Hasta ahora se sabía que estas células utilizaban el citoesqueleto —una red interna de filamentos de actina— para generar una especie de pseudópodo o falso pie frontal llamado lamelipodio, que empuja la membrana hacia adelante y permite avanzar. También se había observado que el núcleo celular, al estar al frente, sirve como una especie de sonda para detectar los caminos más accesibles.
Pero el nuevo estudio muestra que, ante obstáculos estrechos, esto no es suficiente.
Una fuerza oculta en el centro celular
Reis-Rodrigues y su equipo descubrieron que, en estas situaciones de confinamiento extremo, las células dendríticas reorganizan su arquitectura interna. El núcleo se traslada hacia la parte trasera y, en el centro de la célula, entre el frente y el núcleo, se forma una estructura de actina completamente nueva y funcional: el pool central de actina.
Este grupo central no se adhiere al entorno ni se apoya en moléculas de adhesión como las integrinas. En cambio, se encarga de generar una fuerza de empuje perpendicular que literalmente separa las fibras del tejido para abrirse camino.
«El acto de empujar no es hacia adelante, sino hacia los lados. Es como si la célula abriera un paraguas desde el interior para hacerse espacio — señala Reis-Rodrigues. Y añade—: Esto permite que los orgánulos y el núcleo —estructuras grandes y rígidas— puedan avanzar sin quedar atrapados».
Qué pasa si la célula pierde este mecanismo
El equipo quiso comprobar qué sucedía si una célula perdía esta capacidad de empuje. Para ello, trabajaron con células que carecen de la DOCK8, una proteína reguladora clave que organiza el ensamblaje del citoesqueleto. El resultado fue esclarecedor: sin la DOCK8, las células no podían formar esta estructura central, y, al enfrentarse a espacios estrechos, se quedaban atascadas.
Pero no solo eso. Al no haber equilibrio entre la fuerza de empuje central y la protrusión frontal, las células desarrollaban prolongaciones exageradas en su parte delantera: pierden su forma y se fragmentan. Algunas incluso morían en el intento.
«Las células quedaban atrapadas como si fueran coches atascados en un túnel sin salida, intentando avanzar solo con el acelerador del frontal, sin poder despegar la carrocería del suelo», comenta gráficamente Reis-Rodrigues.
Este comportamiento explica, en parte, por qué personas con mutaciones en el gen DOCK8 padecen enfermedades inmunológicas crónicas con infecciones recurrentes y daños en la piel. «No sabíamos exactamente por qué esta mutación tenía consecuencias tan devastadoras. Ahora vemos que, sin esta capacidad mecánica para avanzar, las células no pueden cumplir su función”, añade Reis-Rodrigues.
Patricia Reis-Rodrigues observa en el microscopio del laboratorio del Instituto de Ciencia y Tecnología de Austria (ISTA) cómo las células inmunitarias se abren paso en los tejidos sin causar daños. Crédito: ISTA
Cómo se coordinan las fuerzas celulares internas
El estudio va más allá al mostrar que el pool de actina central y el lamelipodio no actúan de forma aislada, sino que están sincronizados. Si el empuje frontal aumenta, el central disminuye, y viceversa. Es decir, hay una especie de economía interna de fuerzas donde la célula redistribuye recursos según el entorno.
En entornos menos restrictivos, la célula invierte más actina en el frente para acelerar el avance. Pero cuando se enfrenta a obstáculos estrechos, redirige esa actina al centro para abrir espacio y evitar quedar atrapada.
Este equilibrio dinámico, coordinado por proteínas como la Cdc42 y su efector, la DOCK8, es esencial para mantener la coherencia celular. Cuando el frente se acelera sin control y el cuerpo queda atascado, la célula se desintegra.
Aplicaciones biomédicas: qué aporta este descubrimiento
Comprender cómo las células inmunes migran de forma tan eficiente —y cómo fallan al hacerlo— no es solo una cuestión académica. Tiene implicaciones prácticas en múltiples áreas de la medicina:
🛡️ Tratamiento de enfermedades autoinmunes. Al bloquear selectivamente el empuje mecánico de las células, podríamos frenar su avance en tejidos dañados sin inhibir todo el sistema inmune. Aplicable en:
Esclerosis múltiple.
Lupus.
Artritis reumatoide.
🎯 Mejora de inmunoterapia contra el cáncer. Al potenciar esta capacidad de empuje, los linfocitos T activados podrían infiltrarse mejor en:
Tumores sólidos.
Microambientes tumorales densos.
🧱 Inspiración para biomateriales y microrobots
Este modelo celular ofrece claves para diseñar:
Microrobots autónomos sin ruedas.
Materiales inteligentes sensibles al entorno mecánico.
La belleza mecánica de lo invisible
«Resulta fascinante comprobar que estas células, que parecen simples bolsas de membrana, sean en realidad máquinas biomecánicas capaces de detectar su entorno, reorganizar su interior y coordinar fuerzas internas para avanzar sin destruir su entorno», comenta el profesor Michael Sixt, director del estudio.
En palabras de Sixt, «nosotros vemos el sistema inmune como algo que reconoce y responde. Pero también es un sistema que se mueve y que necesita moverse bien para protegernos. Si se atasca o se descoordina, aparecen enfermedade».
Quizá lo más asombroso sea que todo esto ocurre sin que lo notemos. Como señala Reis-Rodrigues con humo, «cuando les cuento a la gente que estas células están constantemente moviéndose dentro de nosotros, muchas me dicen: “¡Qué asco, están dentro de mí!”. Pero sin ellas, no estaríamos vivos».
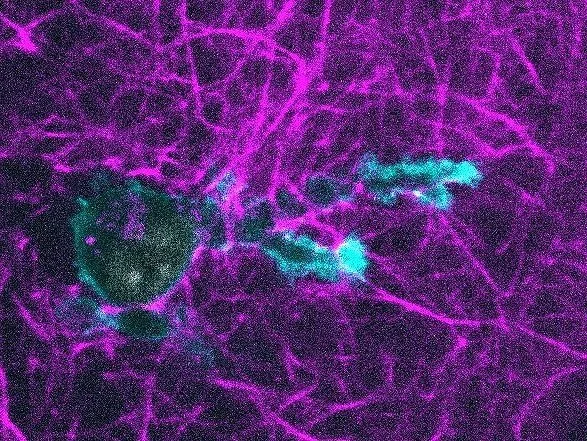
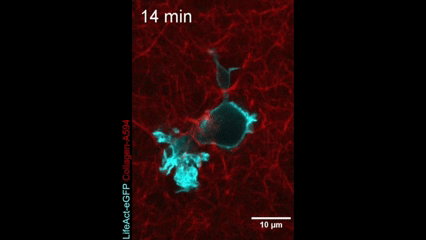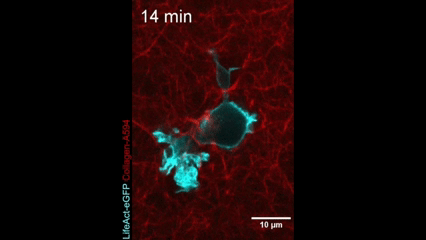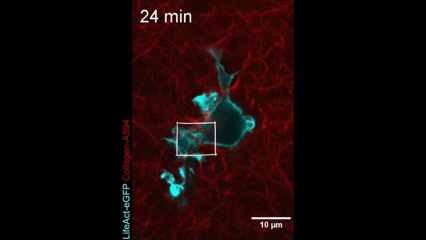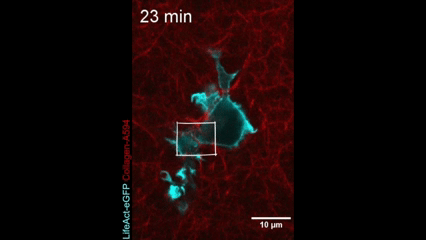
Célula en movimiento. Una célula dendrítica (la actina dentro de la célula se muestra en azul) se arrastra a través de un gel de colágeno (magenta). Crédito: Nature Immunology/Reis-Rodrigues et al.
Un sistema de propulsión alternativo
El estudio también pone en perspectiva cómo las células inmunes difieren de otras, como los fibroblastos y las células cancerosas. Estas últimas, cuando encuentran obstáculos, secretan enzimas proteolíticas que digieren el entorno para abrir camino. Las células inmunes, en cambio, no pueden permitirse ese lujo: destruirían tejidos sanos por donde pasan.
«Si nuestras células inmunes hicieran eso, estaríamos llenos de agujeros —bromea Reis-Rodrigues—. Por eso, la evolución las ha dotado de esta sorprendente capacidad de empujar sin romper».
No cabe duda de que este estudio abre una nueva ventana a la mecánica del sistema inmune, y nos revela que el secreto no está solo en la velocidad o en la fuerza, sino en la coordinación y el equilibrio. Como una sinfonía bien orquestada, donde cada sección del cuerpo celular actúa en armonía, las células inmunes nos protegen no solo con inteligencia biológica, sino con una biomecánica de precisión.
La próxima vez que pienses en Hulk, tal vez debas imaginarlo a escala microscópica: una célula inmunitaria que, sin romper nada, se hace espacio a empujones en los rincones más estrechos del cuerpo, manteniéndonos seguros, sanos y, curiosamente, intactos. ▪️
Células inmunitarias en movimiento. Una célula dendrítica (la actina dentro de la célula se muestra en azul) se arrastra a través de un gel de colágeno (magenta). Crédito: Nature Immunology/Reis-Rodrigues et al.
Información facilitada por el Instituto de Ciencia y Tecnología de Austria
Fuente: Reis-Rodrigues, P., Avellaneda, M.J., Canigova, N. et al. Migrating immune cells globally coordinate protrusive forces. Nature Immunology (2025). DOI: https://doi.org/10.1038/s41590-025-02211-w