Un avance clave hacia la producción de sangre artificial: descubren la señal que desencadena la maduración de glóbulos rojos
Un hallazgo clave acerca a la medicina a un viejo sueño: fabricar sangre humana en laboratorio. Científicos han identificado la señal molecular que desencadena la maduración final de los glóbulos rojos.
Por Enrique Coperías
Julia Gutjahr, junto a un equipo británico, ha identificado la quimiocina CXCL12 como desencadenante de un paso clave en la maduración de los glóbulos rojos. La molécula activa la expulsión del núcleo en los eritroblastos, proceso esencial para producir sangre artificial. Foto: Cassi Josh
Durante décadas, la comunidad científica ha intentado emular en el laboratorio uno de los procesos más asombrosos del cuerpo humano: la producción de sangre artificial. Ahora, un equipo internacional liderado por la Universidad de Constanza (Alemania) y la Queen Mary University of London ha dado un paso decisivo al descubrir una señal molecular que permite replicar uno de los momentos más críticos en la formación de los glóbulos rojos.
Cada día, solo en España, se necesitan alrededor de 15.000 unidades de sangre para cubrir las necesidades de los centros sanitarios. Casi todas provienen de donaciones, pero la necesidad de fuentes alternativas ha impulsado intensas líneas de investigación en busca de métodos que permitan producir sangre artificial a gran escala. Sin embargo, la complejidad del proceso biológico ha sido una barrera persistente.
La bióloga Julia Gutjahr, del Instituto de Biología Celular e Inmunología de Thurgau en la Universidad de Constanza, en Alemnia, lleva años estudiando los mecanismos que rigen la hematopoyesis —la formación natural de la sangre—. Junto a colegas británicos, Gutjahr ha logrado identificar una pieza esencial del rompecabezas: la quimiocina CXCL12, una molécula presente en la médula ósea que desencadena la expulsión del núcleo en los precursores de los glóbulos rojos o eritrocitos, un paso clave en su maduración.
El reto biológico: imitar la maduración celular de los glóbulos rojos
En los mamíferos, recordemos que los glóbulos rojos se forman en la médula ósea a partir de células madre, que dan lugar a eritroblastos. En la etapa final de este desarrollo, el eritroblasto se deshace de su núcleo, lo que permite que la célula se llene de hemoglobina, la proteína responsable del transporte de oxígeno.
Pues bien, hasta ahora, los científicos habían logrado reproducir casi todo este proceso en el laboratorio, salvo este paso final: ¿qué provoca que el núcleo celular sea expulsado? La clave, según los resultados publicados por Gutjahr y su equipo en la revista Science Signaling, está en la CXCL12.
«Hemos descubierto que esta quimiocina, presente principalmente en la médula ósea, puede inducir la expulsión del núcleo si se administra en el momento adecuado», explica Gutjahr.
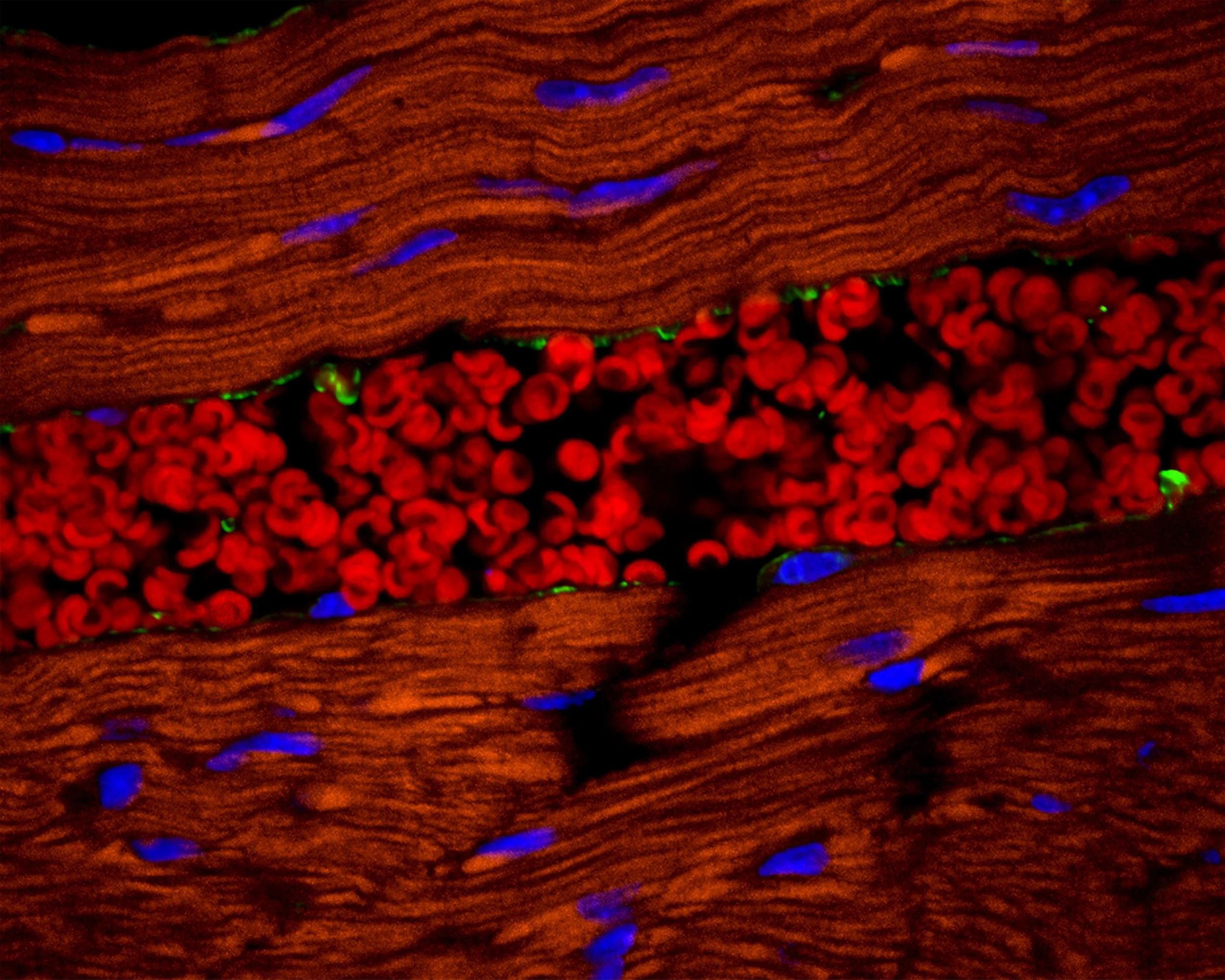
Corte transversal de un tejido muscular humano que revela glóbulos rojos (eritrocitos) dentro de un vaso sanguíneo. Cortesía: Dr. Tomasz Szul / University of Alabama at Birmingham / Nikon Small World
Hacia una sangre de laboratorio más viable
El hallazgo permite por primera vez controlar de manera artificial un paso hasta ahora esquivo, lo que podría mejorar significativamente la eficiencia de la producción de sangre artificial en condiciones de laboratorio.
Más allá de su aplicación inmediata, el descubrimiento también ofrece una nueva visión sobre el funcionamiento celular. Según explica Antal Rot, profesor de la Queen Mary University y codirector del estudio, esta señal química se comporta de forma sorprendente: mientras que en otras células la CXCL12 actúa desde el exterior y desencadena migración celular, en los eritroblastos penetra en el interior celular —incluso en el núcleo—, donde acelera su maduración.
«Es la primera vez que demostramos que los receptores de quimiocinas pueden actuar desde dentro de la célula. Esto abre una nueva perspectiva sobre su papel en la biología celular», afirma Rot.
Del cordón a la reprogramación
Actualmente, la vía más eficaz para generar glóbulos rojos artificiales es mediante células madre obtenidas del cordón umbilical o la médula ósea, con tasas de expulsión nuclear de hasta el 80%. No obstante, estas fuentes son limitadas y poco viables para una producción masiva de sangre artificial.
Una alternativa más prometedora es la reprogramación celular: transformar células adultas en células madre capaces de generar glóbulos rojos. Aunque ofrece un suministro virtualmente ilimitado, este método es más lento y menos eficiente —apenas un 40% de las células expulsan su núcleo—.
«Con nuestros nuevos hallazgos, esperamos mejorar significativamente ese porcentaje gracias a la acción de CXCL12», apunta Gutjahr.
Si se logra una producción artificial a gran escala, las posibilidades serían numerosas. Desde suplir la escasez de donaciones hasta generar tipos sanguíneos raros a demanda o incluso producir sangre personalizada para pacientes con enfermedades específicas. «Aunque el proceso seguirá siendo complejo, abre la puerta a una medicina más precisa y adaptable», concluye Gutjahr.
Por ahora, la sangre artificial aún no está lista para salir del laboratorio, pero el hallazgo de esta señal molecular clave marca un hito esperanzador en esa dirección.▪️
Información facilitada por la Universidad de Constanza
Fuente: Julia Christine Gutjahr et al. Intracellular and nuclear CXCR4 signaling promotes terminal erythroblast differentiation and enucleation. Science Signaling (2025). DOI:10.1126/scisignal.adt2678