Vacuna personalizada contra el cáncer de mama triple negativo: cómo funciona y por qué podría cambiar el tratamiento en cuatro años
El primer ensayo en pacientes confirma el éxito inicial de una vacuna personalizada contra el cáncer de mama triple negativo, el más agresivo. Diseñada a partir del tumor de cada paciente, la vacuna logra activar durante años al sistema inmunitario y podría estar aprobada en apenas cuatro años si nada se tuerce.
Por Enrique Coperías, periodista científico
El cáncer de mama triple negativo, uno de los subtipos más agresivos y difíciles de detectar —a veces invisible en mamografías y ecografías—, podría tratarse en el futuro con vacunas personalizadas capaces de entrenar al sistema inmunitario para prevenir recaídas. Cortesía: Precision Imaging Centers
La idea de una vacuna terapéutica contra el cáncer ha sido durante décadas uno de los grandes anhelos de la medicina. Ahora, un ensayo clínico inicial sugiere que ese objetivo podría estar un poco más cerca para uno de los tumores más agresivos: el cáncer de mama triple negativo (CMTN).
En efecto, un pequeño estudio con pacientes ha mostrado que una vacuna personalizada basada en ARN mensajero puede entrenar al sistema inmunitario para reconocer y atacar las células tumorales durante años, con resultados clínicos prometedores que abren la puerta a una futura aprobación en unos cuatro años si los ensayos clínicos en curso confirman su eficacia.
Sin lugar a dudas, este avance sitúa a las vacunas personalizadas contra el cáncer como una de las estrategias más innovadoras de la oncología actual.
Qué es el cáncer de mama triple negativo y por qué es tan agresivo
El cáncer de mama triple negativo representa alrededor del 15% de todos los tumores de mama, pero es responsable de una proporción mucho mayor de muertes. Suele estar asociado a mujeres jóvenes, menores de cincuenta años, y con frecuencia guarda relación con mutaciones en los genes BRCA1 y BRCA2, que en sus versiones normales producen proteínas que ayudan a reparar el ADN dañado y prevenir la aparición de tumores malignos.
A diferencia de otros tipos de cáncer de mama, carece de tres receptores clave —estrógenos, progesterona y HER2— que permiten tratamientos dirigidos. Esto lo convierte en un enemigo especialmente difícil: suele crecer con rapidez, reaparece con frecuencia incluso en fases tempranas y tiene menos opciones terapéuticas.
Frente a esta agresividad, los investigadores, con el matrimonio de inmunólogos Özlem Türeci y Uğur Şahin, cofundadores de BioNtech (la empresa de biotecnología que desarrolló la primera vacuna del mundo contra la covid-19), a los mandos, han apostado por una estrategia radicalmente distinta: crear una vacuna única para cada paciente, diseñada a partir de las mutaciones específicas de su tumor.
La idea en la que se cimienta es brillante: en lugar de prevenir la enfermedad, como hacen las vacunas tradicionales, estas vacunas contra el cáncer buscan enseñar al sistema inmunitario a detectar restos moleculares exclusivos del cáncer y destruir cualquier célula que los muestre.
Cómo funciona una vacuna personalizada contra el cáncer
El nuevo enfoque se basa en la identificación de los llamados neoantígenos: fragmentos de proteínas producidos por las mutaciones del cáncer y que no existen en las células sanas. Estas piezas pueden actuar como señales de alerta para el sistema inmunitario. Si los linfocitos T aprenden a reconocerlos, pueden convertirse en cazadores altamente selectivos de células tumorales.
El diseño de la vacuna puede resumirse en cuatro grandes pasos:
✅ Paso 1: analizar el tumor de cada paciente. Tras la cirugía, los científicos estudian el ADN del tumor para identificar sus mutaciones específicas.
✅ Paso 2: detectar neoantígenos. Las mutaciones generan proteínas alteradas llamadas neoantígenos, que solo existen en las células cancerosas. Estos fragmentos actúan como señales que el sistema inmunitario puede reconocer.
✅ Paso 3: diseñar una vacuna a medida. Se seleccionan los neoantígenos más prometedores y se crea una molécula de ARN mensajero (ARNm) que contiene instrucciones para producirlos temporalmente en el organismo.
✅ Paso 4: entrenar al sistema inmunitario. El ARNm se introduce mediante nanopartículas lipídicas, tecnología similar a la de algunas vacunas contra la covid-19. Las células inmunitarias aprenden a reconocer esos neoantígenos y a destruir cualquier célula que los presente.
Cada vacuna es única y personalizada: puede incluir hasta 20 mutaciones específicas del tumor de una sola paciente. Es, en sentido literal, un tratamiento personalizado que solo sirve para esa persona.
Resultados del primer ensayo clínico en pacientes
El estudio inicial incluyó a catorce mujeres con cáncer de mama triple negativo en fases tempranas. Todas habían sido operadas y habían recibido tratamientos estándar, como quimioterapia y radioterapia. En ese momento no presentaban signos de enfermedad, pero el riesgo de recaída del cáncer seguía siendo alto, especialmente durante los primeros tres años tras el diagnóstico.
Las pacientes recibieron ocho dosis de su vacuna personalizada en un periodo de aproximadamente dos meses. El objetivo principal no era demostrar una curación definitiva —el ensayo era pequeño y sin grupo de control—, sino comprobar si la estrategia era viable, segura y capaz de activar el sistema inmunitario.
Los resultados fueron llamativos. En casi todas las pacientes se detectaron respuestas de linfocitos T contra múltiples neoantígenos del tumor. Es decir, el sistema inmunitario había aprendido a reconocer varias señales específicas del cáncer y a reaccionar frente a ellas.
Además, esas respuestas no fueron efímeras. Los análisis de sangre mostraron que los linfocitos T activados por la vacuna permanecían en el organismo durante años, en algunos casos hasta seis años después de la vacunación.
Una memoria inmunitaria duradera
El hallazgo más relevante no fue solo la aparición de linfocitos contra el tumor, sino su persistencia y evolución. Los científicos observaron que muchas de esas células se transformaban en dos tipos especialmente valiosos:
1️⃣ Por un lado, linfocitos citotóxicos listos para actuar de inmediato.
2️⃣ Por otro lado, células con características de memoria inmunitaria a largo plazo, capaces de multiplicarse si el tumor reaparece.
Esta combinación es la que permite al sistema inmunitario combatir infecciones durante décadas tras una vacunación. En el contexto del cáncer, podría traducirse en una vigilancia permanente frente a posibles recaídas.
En algunos casos, la magnitud de la respuesta fue comparable a la observada en terapias celulares avanzadas, como la transferencia de linfocitos modificados en laboratorio. Sin embargo, aquí se conseguía mediante una simple vacunación.
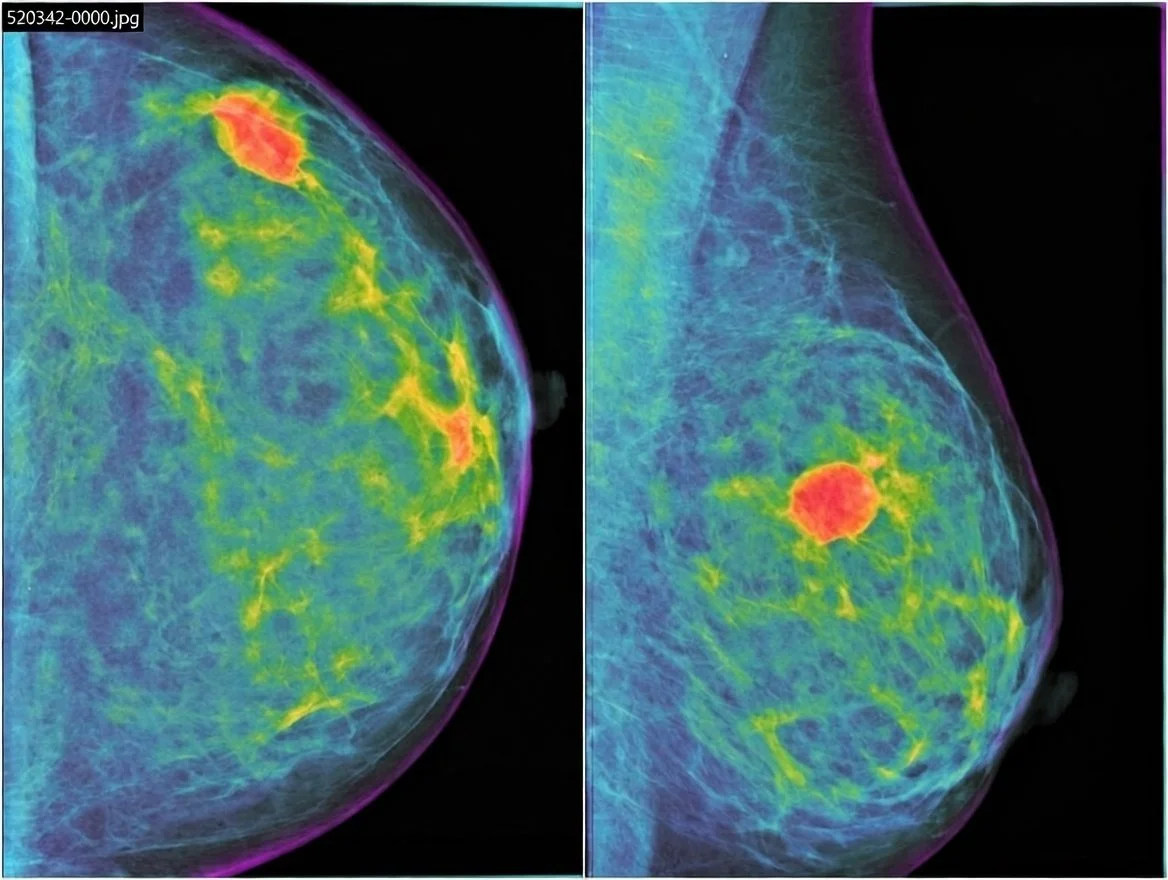
Imagen mamográfica coloreada de un cáncer de mama triple negativo: una masa de contorno ovalado y bordes bien definidos en gran parte de la lesión, pero con zonas difusas que dificultan su identificación, un rasgo que complica el diagnóstico de este tumor agresivo para el que se investiga una vacuna personalizada.
Resultados clínicos iniciales
Aunque el estudio no estaba diseñado para medir la eficacia clínica de forma definitiva, los datos preliminares resultan alentadores. Once de las catorce pacientes permanecieron libres de recaída durante el periodo de seguimiento, que en algunos casos alcanzó seis años.
Tres pacientes experimentaron recurrencias del cáncer. En una de ellas, la respuesta inmunitaria inducida por la vacuna había sido débil; otra presentaba un tumor que había perdido la capacidad de mostrar los neoantígenos al sistema inmunitario; la tercera desarrolló un nuevo tumor genéticamente distinto al original, por lo que la vacuna diseñada para el primero no podía reconocerlo.
Estos casos ofrecen pistas valiosas sobre los mecanismos de escape del cáncer. Algunos tumores pueden volverse invisibles al sistema inmunitario reduciendo la presentación de antígenos; otros pueden surgir a partir de clones distintos. Comprender estos procesos será clave para mejorar las futuras versiones de la vacuna.
Efectos secundarios leves
En términos de seguridad, la vacuna fue bien tolerada. Los efectos secundarios más frecuentes fueron fiebre leve, fatiga, escalofríos o dolor de cabeza, similares a los de muchas vacunas convencionales y generalmente de corta duración.
Esto resulta especialmente relevante en pacientes que ya han pasado por tratamientos agresivos como la quimioterapia.
Una terapia preventiva con pocos efectos secundarios podría mejorar notablemente la calidad de vida en la fase posterior al tratamiento.
Un cambio de paradigma
La investigación, cuyos resultados recoge la revista Nature, se inscribe en una tendencia más amplia: el uso de vacunas de ARN personalizadas contra distintos tumores. Estudios previos en melanoma y cáncer de páncreas ya habían demostrado que este enfoque puede generar respuestas inmunitarias potentes. Sin embargo, el cáncer de mama triple negativo presenta una carga mutacional menor que el melanoma, lo que hacía dudar de su idoneidad para esta estrategia.
El ensayo muestra que, incluso con un número moderado de mutaciones, es posible inducir respuestas inmunitarias robustas en prácticamente todos los pacientes.
Además, el proceso de fabricación —desde el análisis del tumor hasta la vacuna final— se completó en una media de unos dos meses, demostrando que la producción individualizada es factible en un entorno clínico real.
Lo que falta por demostrar
A pesar del entusiasmo, los propios investigadores subrayan las limitaciones del estudio. El número de pacientes es reducido y no existe un grupo de control para comparar resultados.
Será necesario realizar ensayos clínicos más grandes y aleatorizados para confirmar si la vacuna reduce de forma significativa el riesgo de recaída y mejora la supervivencia.
También será clave explorar combinaciones con otras terapias inmunológicas, como los inhibidores de puntos de control inmunitario, que pueden potenciar la actividad de los linfocitos T. En uno de los casos del ensayo, una paciente que recayó tras una respuesta inmunitaria débil logró una remisión completa temporal cuando recibió inmunoterapia adicional, lo que sugiere posibles sinergias.
Una ventana de oportunidad
Si los ensayos de fase avanzada confirman los resultados preliminares, la vacuna podría estar disponible en unos cuatro años. Sería uno de los primeros tratamientos personalizados basados en ARN contra el cáncer en llegar a la práctica clínica.
Más allá del cáncer de mama triple negativo, el enfoque podría aplicarse a otros tumores sólidos. La idea de una vacuna personalizada contra el cáncer, diseñada a partir de las mutaciones de su propio tumor, deja de ser una promesa lejana para convertirse en una posibilidad tangible.
El desafío ahora es demostrar que esa memoria inmunitaria duradera se traduce en menos recaídas y más supervivencia. Si se logra, la oncología podría entrar en una nueva era en la que, tras eliminar el tumor visible, una vacuna personalizada se encargue de vigilar silenciosamente durante años, preparada para actuar si el cáncer intenta regresar.▪️(18-febrero-2025)
PREGUNTAS&RESPUESTAS: cáncer de mama triple negativo y vacuna
🩻 ¿Existe ya una vacuna contra el cáncer de mama triple negativo?
Aún no está aprobada. Los ensayos clínicos iniciales muestran resultados prometedores y podría aprobarse en unos cuatro años si los estudios avanzados confirman su eficacia.
🩻 ¿Cómo funciona la vacuna personalizada contra el cáncer?
Analiza las mutaciones del tumor de cada paciente, crea una vacuna de ARN con esas mutaciones y entrena al sistema inmunitario para reconocer y destruir células cancerosas.
🩻 ¿Es una vacuna preventiva?
No. Es una vacuna terapéutica que se administra después del tratamiento del cáncer para evitar recaídas.
🩻 ¿Tiene efectos secundarios?
Los efectos observados hasta ahora son leves y temporales, similares a los de muchas vacunas convencionales.
🩻 ¿Podría usarse en otros cánceres?
Sí. La tecnología de vacunas personalizadas de ARN se está investigando en varios tipos de tumores.
Fuente: Sahin, U., Schmidt, M., Derhovanessian, E. et al. Individualized mRNA vaccines evoke durable T cell immunity in adjuvant TNBC. Nature (2026). DOI: https://doi.org/10.1038/s41586-025-10004-2