Científicos descubren pequeños bucles en el ADN de las células en división
Cuando una célula se divide, su ADN no se disuelve en el caos: mantiene pequeños bucles que actúan como anclas de memoria, listos para reconstruir la vida en cuanto todo vuelve a empezar, según una investigación del MIT.
Por Enrique Coperías
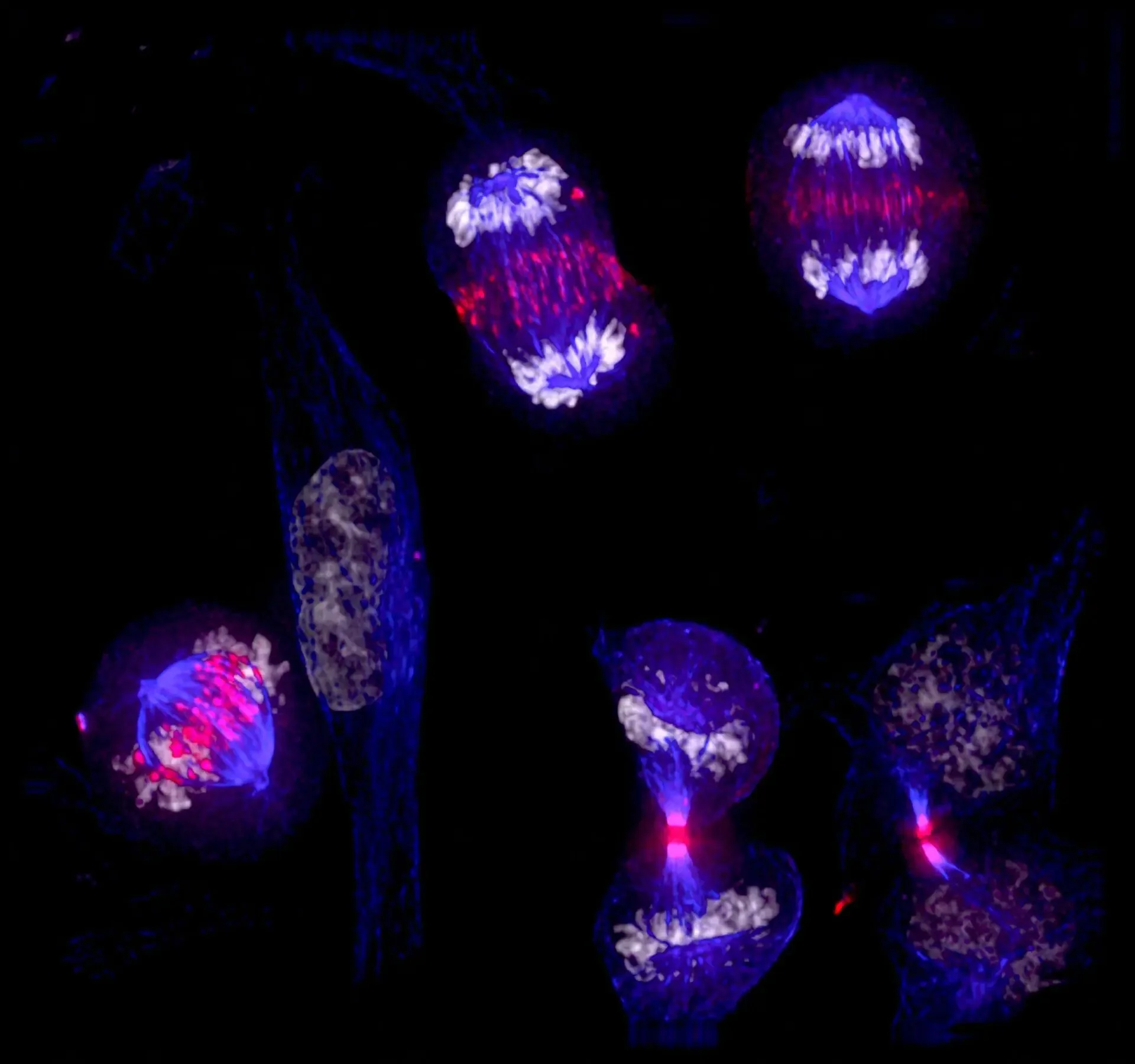
Célula pulmonar de tritón durante la mitosis, en la que se distinguen cinco estructuras diferentes del proceso de división celular. La imagen muestra el orden y la precisión con que el material genético se reparte entre las células hijas. Cortesía: Alexey Khodjakov / Wadsworth Center / https://www.nikonsmallworld.com/
Hasta ahora, los biólogos celulares habían descrito la mitosis —el proceso en que una célula se divide en dos— como una suerte de apagón temporal: los cromosomas se condensan, el núcleo desaparece y la actividad genética queda prácticamente detenida hasta que la nueva célula vuelve a arrancar su maquinaria.
Sin embargo, un grupo de investigadores del Instituto Tecnológico de Massachusetts (MIT) y de la Universidad de Pensilvania, en Estados Unidos, ha observado algo inesperado: incluso en pleno caos de la división celular, el genoma conserva una organización interna sorprendentemente refinada, en forma de minúsculos bucles o microcompartimentos que podrían ser clave para reactivar la lectura del ADN.
El hallazgo, publicado esta semana en la revista Nature Structural & Molecular Biology, desafía una de las ideas más arraigadas en biología molecular: que durante la mitosis la arquitectura tridimensional del genoma se desmantela por completo y debe reconstruirse desde cero. «Hasta ahora creíamos que los cromosomas se convertían en simples ladrillos empaquetados sin orden funcional —explica Anders Hansen, físico y biólogo en el MIT y uno de los autores principales. Y añade en un comunicado de esta institución—: Lo que hemos visto es que, incluso en ese estado compacto, el ADN mantiene pequeñas islas de organización que parecen preparar el terreno para el reinicio de la célula».
En palabras de Hansen, «el nuevo estudio realmente ayuda a aclarar cómo debemos pensar en la mitosis. En el pasado, esta se concebía como una pizarra en blanco, sin transcripción y sin estructura relacionada con la actividad génica. Ahora sabemos que eso no es del todo cierto. Lo que vemos es que siempre hay estructura. Nunca desaparece».
Una nueva técnica para ver el ADN con detalle sin precedentes
Para llegar a esta conclusión, los investigadores emplearon una técnica de vanguardia llamada RCMC (region capture Micro-C), una versión ultrafina del conocido método Hi-C, que permite cartografiar las interacciones físicas del ADN dentro del núcleo celular.
Mientras que el Hi-C tradicional detecta grandes estructuras, como los dominios topológicos (TAD) y los compartimentos A/B, la versión mejorada logra captar contactos mucho más pequeños, del orden de unos pocos miles de bases. Es como pasar de una foto satelital del genoma a una imagen microscópica de sus calles y callejones.
Mediante la RCMC, el equipo siguió en tiempo real la evolución de los cromosomas de células de ratón que pasaban de la prometafase (cuando los cromosomas están totalmente compactados) hasta las primeras etapas del ciclo siguiente, la fase G1, cuando el núcleo y la transcripción genética se restablecen.
Recordemos que la transcripción es la lectura del ADN para producir ARN mensajero, que viaja fuera del núcleo y sirve de molde para sintetizar una determinada proteína en los ribosomas, en un proceso posterior llamado traducción. Durante la división celular o mitosis, la célula empaqueta el ADN de forma muy compacta para poder repartirlo entre las dos células hijas. En ese momento, la transcripción se detiene casi por completo, porque las enzimas no pueden acceder al ADN comprimido.
Contra todo pronóstico, los mapas revelaron que en pleno apretón mitótico persistían miles de pequeños lazos entre regiones del ADN llamadas elementos reguladores, como promotores y potenciadores (enhancers). Estos lazos formaban patrones de interacciones en red, a modo de retícula, que los autores denominaron microcompartimentos.
Microcompartimentos, bucles diminutos que conectan la memoria genética
Los microcompartimentos, explican los autores, son estructuras de unas pocas kilobases que conectan regiones del genoma con funciones afines, como genes activos y sus elementos reguladores cercanos. A diferencia de los grandes lazos estructurales mediados por proteínas como la CTCF y la cohesina, estos bucles parecen formarse por afinidad local, como gotas que se agrupan por similitud química. En los mapas tridimensionales del ADN, aparecen como una cuadrícula de puntos intensos, anidados unos dentro de otros.
Hasta ahora se pensaba que ese entramado se desvanecía por completo cuando la célula se dividía. Pero las imágenes de RCMC mostraron justo lo contrario: los microcompartimentos no solo persisten durante la mitosis, sino que aumentan en fuerza durante la anafase y la telofase —cuando las dos copias del genoma se separan y la célula empieza a reorganizar su núcleo—, para luego debilitarse de nuevo una vez que el ciclo celular avanza. Es decir, florecen brevemente justo cuando la célula vuelve a la vida.
«Durante la mitosis, se creía que casi toda la transcripción génica se detenía. Y antes de nuestro trabajo, también se pensaba que toda la estructura tridimensional relacionada con la regulación génica se perdía y era reemplazada por la compactación. Era un reinicio completo en cada ciclo celula —explica Hansen. Y añade—: Entramos en este estudio pensando: “bueno, lo único que sabemos con seguridad es que no hay estructura reguladora en la mitosis”… y luego, por accidente, encontramos estructura en la mitosis».
Experimentos del MIT han revelado la existencia de microcompartimentos (en amarillo) dentro de la estructura tridimensional del genoma, formados por diminutos bucles de ADN que podrían intervenir en la regulación de los genes. Crédito: Edward Banigan / MIT
Un pico de actividad genética en pleno caos celular
Ese comportamiento transitorio llamó la atención de los investigadores, porque coincide con otro fenómeno intrigante: un pico fugaz de transcripción que ocurre justo al final de la mitosis. Aunque la mayor parte de la actividad genética se detiene durante la división, como ya se ha mencionado, varios estudios habían observado que ciertos genes se encienden de forma explosiva al salir de la fase mitótica. La función de ese estallido —una especie de chispazo biológico— seguía siendo un misterio.
Al superponer sus datos estructurales con mediciones de RNA polimerasa II, la enzima que inicia la transcripción, los científicos comprobaron que los promotores con picos de actividad coincidían con los anclajes de los microcompartimentos. En otras palabras: los genes que experimentaban ese spike de transcripción eran precisamente aquellos que formaban más y más fuertes lazos durante la mitosis.
«Parece que estas microestructuras actúan como puntos calientes donde el ADN se prepara para reactivar la maquinaria genética —señala Edward Banigan, coautor del estudio—. Es como si la célula dejara puentes montados para acelerar el arranque después del apagón».
«Casi parece que ese aumento transitorio de la transcripción durante la mitosis es un accidente indeseado que surge al generar un entorno especialmente favorable para la formación de microcompartimentos durante la mitosis —comenta Hansen—. Luego, la célula elimina y filtra rápidamente muchos de esos bucles cuando entra en G1».
Dos niveles de organización: macrocompartimentos y microcompartimentos
Los análisis revelan que existen al menos dos niveles de organización tridimensional en el genoma:
✅ Los grandes compartimentos A/B, que reflejan zonas activas e inactivas del ADN y que dependen en gran medida de proteínas extrusoras como cohesina y condensina.
✅ Los microcompartimentos, mucho más pequeños y transitorios, que surgen de la afinidad entre elementos reguladores y que son menos sensibles a las proteínas de andamiaje.
Para comprobarlo, el equipo repitió los experimentos en células donde habían eliminado una de esas proteínas clave, la condensina, responsable de mantener la compactación cromosómica durante la mitosis. El resultado fue revelador, puesto que, al desaparecer condensina, los grandes compartimentos A/B se volvían más marcados, pero los microcompartimentos apenas cambiaban.
Esto sugiere que ambos niveles de organización siguen reglas físicas distintas: los macrocompartimentos dependen de la maquinaria de extrusión, mientras que los microcompartimentos se rigen por fuerzas de afinidad y por el grado de compactación del ADN.
«El estudio aprovecha la resolución genómica sin precedentes de la técnica RC-MC para revelar aspectos nuevos y sorprendentes de la organización de la cromatina durante la mitosis, que habíamos pasado por alto hasta ahora con los métodos tradicionales —opina Effie Apostolou, profesora de biología molecular en Weill Cornell Medicine, que no participó en el trabajo—. Los autores muestran que, contrariamente a la pérdida generalizada de los dominios topológicos y compartimentos durante la mitosis, las microestructuras más finas se mantienen o incluso se refuerzan transitoriamente».
«La mitosis ya no puede verse como una pizarra en blanco sin estructura ni actividad genética. Siempre hay orden en el genoma, nunca desaparece», explica Anders Sejr Hansen, profesor de Ingeniería Biológica en el MIT. Cortesía: MIT / Anders Sejr Hansen
Simulaciones que explican el origen físico del ADN plegado
Para entender de dónde surge esa estructura, los autores desarrollaron modelos computacionales de polímeros que simulaban el comportamiento del ADN bajo diferentes condiciones físicas: variando la densidad del cromosoma, la velocidad de las proteínas extrusoras y la fuerza de atracción entre segmentos similares.
Las simulaciones reprodujeron fielmente las observaciones experimentales: los microcompartimentos se formaban de manera natural cuando el ADN estaba más compactado —como en la mitosis— y tendían a disolverse cuando el material genético se relajaba en G1.
Además, los modelos demostraron que una mayor actividad de extrusión (más movimiento de condensinas o cohesinas) tiende a borrar los microcompartimentos, mientras que una densidad cromosómica alta los refuerza. En resumen: la compactación del ADN favorece su aparición, la extrusión los debilita. Esta dinámica explica por qué los microcompartimentos se intensifican justo antes de que el genoma se desenrolle y por qué desaparecen cuando la célula recupera su estado interfasico.
Un nuevo paradigma en la organización del genoma y la expresión génica
El descubrimiento de estas estructuras efímeras obliga a replantear cómo entendemos la continuidad funcional del genoma durante la división celular. Lejos de ser un proceso de destrucción total, la mitosis parece conservar una memoria estructural que guía el restablecimiento del programa genético. «Es una forma elegante de que la célula mantenga la identidad sin tener que reconstruir todo desde cero», resume Hansen.
«Los resultados ayudan a tender un puente entre la estructura del genoma y su función en la regulación génica, algo que ha sido un desafío pendiente en este campo durante décadas», afirma Viraat Goel, autor principal del trabajo.
Los microcompartimentos podrían ser, además, una pista para entender cómo algunas células reprograman su expresión génica en momentos críticos, como la diferenciación embrionaria y la regeneración de tejidos. También podrían ayudar a explicar por qué ciertos genes son más propensos a errores de transcripción tras la división, un fenómeno implicado en el envejecimiento y en el cáncer.
El genoma como una ciudad viva y cambiante
El trabajo refuerza la idea de que el genoma no es una simple cadena de información, sino una ciudad tridimensional en constante transformación, donde las calles del ADN (los lazos) y los barrios genéticos (los compartimentos) cambian de forma según el momento del ciclo celular.
En ese paisaje, los microcompartimentos serían como plazas efímeras que se levantan para coordinar la reactivación del tráfico genético.
«En la metáfora urbana del genoma, sabíamos que existían las grandes avenidas que conectan barrios enteros. Ahora descubrimos pequeñas rotondas que aparecen y desaparecen justo cuando la ciudad vuelve a encenderse tras un corte de luz», escribe Banigan.
Implicaciones biomédicas y futuras investigaciones
Los autores planean ahora investigar si los microcompartimentos también se forman en células humanas y qué proteínas concretas los mantienen. Una de las hipótesis es que estén relacionados con los factores de transcripción que permanecen asociados al ADN incluso durante la mitosis, actuando como marcadores de memoria que señalan dónde deben volver a activarse los genes.
«Estamos pensando en algunos contextos biológicos naturales en los que las células cambian de forma y tamaño, y en si podríamos explicar así ciertos cambios en el genoma tridimensional que hasta ahora no tenían explicación —dice Hansen—. Otra pregunta clave es cómo decide la célula qué microcompartimentos conservar y cuáles eliminar al entrar en G1, para asegurar la fidelidad en la expresión génica».
El hallazgo tiene numerosas implicaciones. Por ejemplo, podría ayudar a entender cómo ciertas terapias genéticas o fármacos anticancerígenos que interfieren con la compactación cromosómica afectan a la reactivación del genoma. También abre una puerta para explorar nuevas formas de controlar la expresión génica manipulando la arquitectura física del ADN.
Un recordatorio de la elegancia biológica
En última instancia, este trabajo pone de relieve la sofisticación del genoma y la precisión biológica con que la naturaleza gestiona incluso los procesos más radicales. Durante la mitosis, la célula parece desmantelar su núcleo, apagar su ADN y empaquetar sus cromosomas con brutal eficiencia.
Pero, en realidad, nunca pierde del todo el hilo. Los microcompartimentos actúan como finos cables de continuidad entre el orden y el caos, garantizando que, tras la tormenta, cada célula hija recuerde quién es.
«Ver cómo el genoma se reorganiza con tanta precisión en un momento tan crítico es asombroso. Nos muestra que, incluso en los instantes en que todo parece destruido, la vida mantiene su estructura más íntima», concluye Hansen. ▪️
Información facilitada por MIT News
Fuente: Goel, V. Y., Aboreden, N. G., Jusuf, J. M. et al. Dynamics of microcompartment formation at the mitosis-to-G1 transition. Nature Structural & Molecular Biology (2025). DOI: https://doi.org/10.1038/s41594-025-01687-2