Descubren un nuevo interruptor para activar el «suicidio» celular
Un equipo internacional ha identificado en el corazón de las mitocondrias una diminuta pieza estructural capaz de decidir entre la vida y la muerte celular. El hallazgo abre nuevas vías para tratar el cáncer, el alzhéimer y otras muchas enfermedades.
Por Enrique Coperías
Un equipo de científicos en Alemania ha logrado describir por primera vez a nivel atómico cómo actúa un interruptor molecular que en posición ON desencadenar la cascada de la apoptosis, una especie de suicidio programado que hace posible la destrucción de las células dañadas, evitando, por ejemplo, la aparición de enfermedades como el cáncer. Imagen conceptual generada con Copilot
En el interior de nuestras células, las mitocondrias no solo fabrican la energía que sostiene la vida: también esconden los mecanismos que pueden ponerle fin. La apoptosis, también conocida como muerte celular programada o suicidio celular, es un proceso esencial para el equilibrio del organismo.
Permite eliminar células dañadas o envejecidas, y, cuando falla, puede dar lugar a enfermedades como el cáncer y la neurodegeneración. Un estudio publicado en Nature Communications por investigadores de la Universidad Técnica de Múnich (TUM) y el Helmholtz Center de Alemania detalla un nuevo engranaje clave de ese proceso. Se trata de un diminuto interruptor molecular dentro del canal mitocondrial VDAC1, una proteína que, con un leve cambio en su estructura, puede pasar de funcionar como una puerta de paso de energía y metabolitos a convertirse en un disparador del proceso de muerte celular.
El trabajo, liderado por el bioquímio Franz Hagn, del Departamento de Biociencias en la Universidad Técnica de Múnich, descifra por primera vez a nivel atómico cómo un cambio en la arquitectura de este canal de aniones dependiente del voltaje o VDAC puede desencadenar la cascada de la apoptosis.
Una estructura tridimensional que revela el mecanismo de la apoptosis
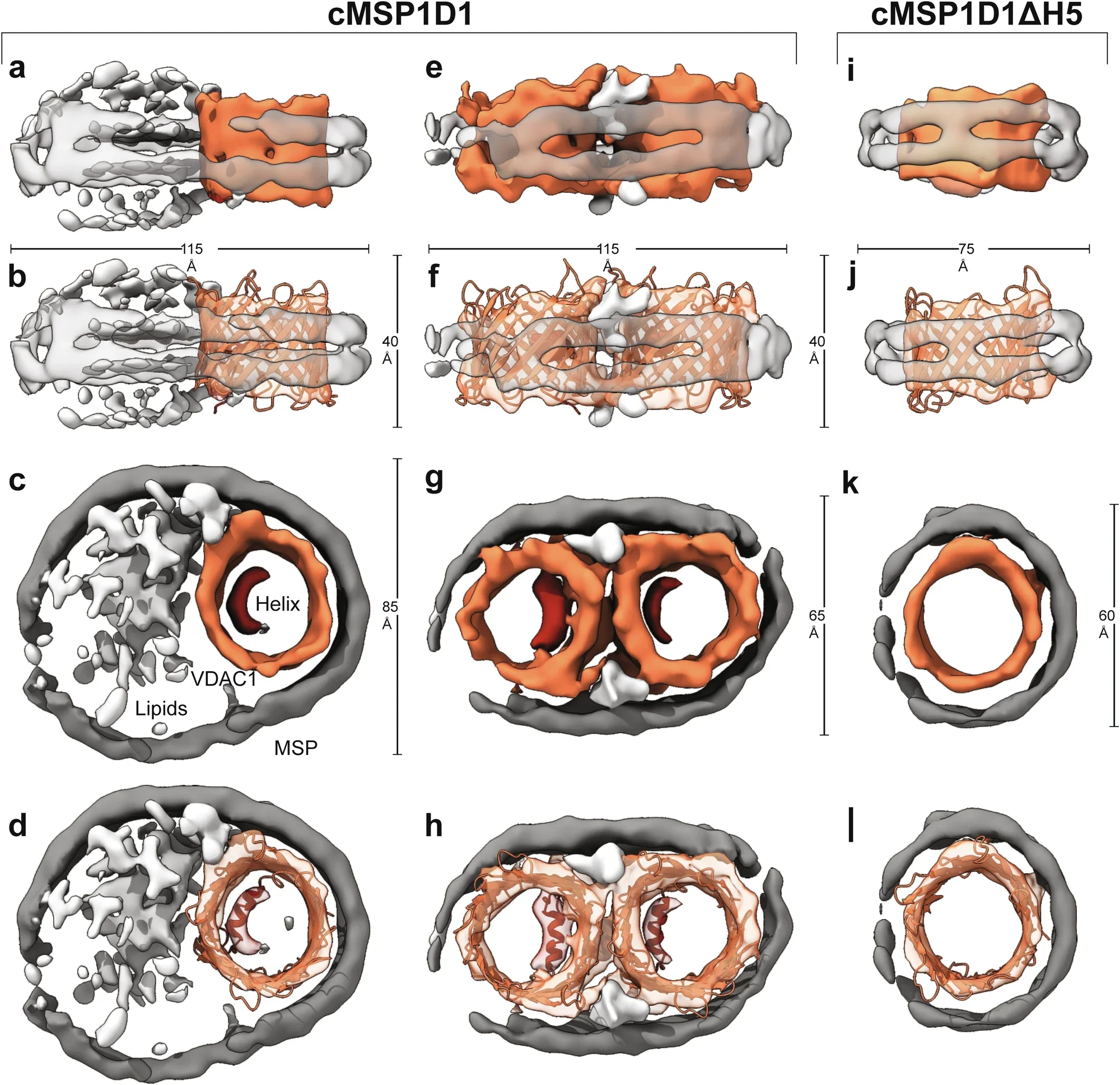
La investigación combina las técnicas estructurales más potentes de la biología actual, como son la criocristalografía electrónica (cryo-EM), la resonancia magnética nuclear (NMR) y la cristalografía de rayos X, para mostrar que, bajo condiciones de estrés o daño mitocondrial, la proteína VDAC1 sufre una transformación decisiva: su hélice alfa N-terminal se libera del interior del canal y se expone al exterior de la membrana.
Ese movimiento, aparentemente insignificante, convierte a la proteína en un agente proapoptótico, o sea, que favorece o activa la muerte celular programada.
🗣️ «Muchos equipos de investigación en todo el mundo están trabajando en el apasionante tema de la apoptosis y su control dirigido —explica el profesor Hagn en un comunicado de la TUM. Y añade—: La gran ventaja es que tratamos con un mecanismo regulador altamente eficiente, desarrollado a lo largo de la evolución. Así que no tenemos que inventar algo completamente nuevo, sino utilizar los métodos estructurales adecuados para aprender de los procesos optimizados de la naturaleza».
Cómo la proteína VDAC1 pasa de guardiana a verdugo
En condiciones normales, la VDAC1 actúa como una puerta de entrada y salida de metabolitos, como el ATP, el glutamato y el calcio, entre la mitocondria y el resto de la célula. Es una de las proteínas más abundantes de la membrana mitocondrial externa y su estructura está compuesta por un cilindro formado por diecinueve láminas beta que rodean una hélice alfa interna. Esa hélice, explican los autores, es la clave del cambio funcional.
Los investigadores observaron que cuando la VDAC1 forma agrupaciones —oligómeros— o se ve sometida a un entorno con carga negativa, como el que se produce durante el estrés oxidativo y los desequilibrios metabólicos, su hélice interna se desprende del canal y queda expuesta.
Este sutil movimiento no destruye la estructura del canal, pero la hace más flexible e inestable. Es entonces cuando el canal deja de comportarse como un simple conducto de metabolitos y se convierte en una plataforma de interacción con otras proteínas, en particular con las de la familia Bcl-2, que controlan la vida y la muerte de las mitocondrias, las centrales energéticas de las células.
Reconstrucción del canal mitocondrial VDAC1 en nanodiscos de lípidos: el modelo revela cómo cambia su estructura y cómo la hélice interna (en rojo) se desplaza al activarse la apoptosis. Cortesía: Daniilidis, M., Günsel, U., Broutzakis, G. et al.
El juego de fuerzas de la familia Bcl-2
La familia de proteínas Bcl-2 actúa como una especie de consejo de guerra dentro de la célula. Y lo hacen desde dos frentes principales:
✅ Unas son guardianas que evitan la muerte, como la Bcl-xL y la Bcl-2.
✅ Otras intervienen como ejecutoras o activadoras de la apoptosis, caso de la Bak, la Bax y las denominadas BH3-only.
El equilibrio entre unas y otras decide si la célula sobrevive o se autodestruye. Lo que el equipo de Hagn ha descubierto es que la hélice expuesta de VDAC1 se comporta como un imitador de las proteínas proapoptóticas BH3, capaces de neutralizar a las guardianas.
Los experimentos de resonancia magnética nuclear mostraron que la hélice N-terminal de VDAC1, una vez expuesta, se une específicamente al surco de unión BH3 de Bcl-xL, el mismo sitio donde se acoplan las proteínas proapoptóticas para desactivar su función.
«En nuestro estudio utilizamos métodos estructurales de alta resolución, como la resonancia magnética nuclear (NMR), la cristalografía de rayos X y la microscopía crioelectrónica, para investigar cómo cambia la proteína VDAC1 bajo condiciones de estrés —explican los doctores Umut Günsel y Melina Daniilidis, coautores principales del trabajo. Y continúa—: También combinamos estos datos con experimentos funcionales bioquímicos para demostrar que VDAC1 realmente se une a la proteína inhibidora Bcl-xL, promoviendo así la apoptosis».
«Es como si el propio canal mitocondrial, en respuesta al daño, sacara un as bajo la manga y adoptara el papel de verdugo —dicen Hagn y sus colegas en el artículo. Al unirse a la Bcl-xL, la VDAC1 impide que esta bloquee a la Bak, la proteína que perfora la membrana mitocondrial y libera el citocromo c, paso clave en la ejecución de la apoptosis.
Una estructura tridimensional que señala el mecanismo de la apoptosis
El grupo consiguió además cristalizar el complejo formado por la Bcl-xL y la hélice de VDAC1, y obtener una imagen detallada de su interacción a una resolución de 1,95 angstroms. En esa estructura, la hélice de VDAC1 se encaja como una llave en la ranura de la Bcl-xL, y ocupa el mismo espacio que normalmente usarían las proteínas BH3.
Las simulaciones moleculares y los experimentos de mutagénesis confirmaron que un solo aminoácido, la leucina en la posición 10, es esencial para esa unión: sustituirla por la alanina reduce veinte veces la afinidad y elimina la capacidad proapoptótica del fragmento.
El hallazgo aclara una controversia mantenida durante décadas entre los biólogos sobre el papel real de la VDAC en la muerte celular. Hasta ahora, algunos estudios habían propuesto que los oligómeros de la VDAC formaban poros gigantes por donde escapaban las proteínas proapoptóticas. Pero los nuevos experimentos demuestran que el canal no llega a formar tales orificios: más bien actúa como un regulador indirecto, un sensibilizador que retira los frenos moleculares de la apoptosis al desactivar a las proteínas antiapoptóticas.
VDAC1, el sensor mitocondrial del estrés celular
El nuevo trabajo también identifica las condiciones que provocan la exposición de la hélice y, por tanto, el encendido del interruptor de la muerte celular. Los investigadores comprobaron que el canal VDAC1 tiende a oligomerizarse —y con ello a exponer su hélice— cuando se encuentra en entornos cargados negativamente o ricos en ciertos lípidos y detergentes similares a los que se acumulan en mitocondrias dañadas.
Además, variantes más estables de la proteína, como la mutante E73V, muestran una menor tendencia a formar oligómeros y son, por tanto, más resistentes al cambio proapoptótico.
La conclusión es que el canal VDAC1 actúa como un sensor interno del estado de salud de la mitocondria: cuando la membrana se altera por oxidación, cambios de pH o exceso de calcio, el canal detecta esa perturbación y saca su hélice hacia fuera, iniciando así la cascada de acontecimientos bioquímicos que conducirá al suicidio de la célula afectada.
En ese sentido, VDAC1 no es un mero participante, sino un vigilante molecular capaz de decidir cuándo una célula está demasiado dañada para seguir viviendo.
Franz Hagn (en primer plano) y Umut Günsel, dos de los científicos protagonistas del hallazgo, en el laboratorio del Departamento de Biociencias en la Universidad Técnica de Múnich. Cortesía: Astrid Eckert / TUM
Aplicaciones biomédicas: del cáncer al alzhéimer
El descubrimiento tiene importantes implicaciones para el tratamiento de enfermedades en las que la apoptosis está desregulada. En el cáncer, por ejemplo, las células logran sobrevivir porque las proteínas antiapoptóticas como la Bcl-xL y la Mcl-1 permanecen activas, bloqueando la acción de la Bak y la Bax.
En palabras de los autores, comprender cómo el canal VDAC1 puede interferir con esas proteínas abre una nueva vía para diseñar fármacos que imiten su hélice N-terminal o que induzcan su exposición de forma controlada. En sentido opuesto, en enfermedades neurodegenerativas, como el alzhéimer, o en el infarto cerebral y cardíaco, donde la apoptosis excesiva destruye neuronas o cardiomiocitos, la inhibición de ese mecanismo podría proteger a los tejidos.
Los autores subrayan que la VDAC1, por su posición estratégica y su abundancia en la membrana mitocondrial, podría convertirse en un objetivo privilegiado para terapias dirigidas. «Nuestro trabajo revela un nuevo principio regulador en las proteínas de barril beta de membrana [proteínas que forman canales o poros en las membranas celulares, como la VDAC1]. La capacidad de estas proteínas para cambiar de conformación y exponer regiones funcionales podría ser una forma general de modular sus interacciones y funciones», podemos leer en el artículo científico.
Un nuevo paradigma sobre la mitocondria y la vida celular
En última instancia, el estudio de Hagn y su equipo redefine el papel de la mitocondria en la toma de decisiones celulares. Más que un simple generador de energía, emerge como un árbitro molecular que evalúa continuamente el estado de la célula y, llegado el momento, activa su autodestrucción.
El canal VDAC1, situado en la frontera entre la vida y la muerte, sería su interruptor maestro: una estructura capaz de pasar, con un giro de hélice, de distribuir energía a ejecutar el programa de suicidio celular.
En palabras del propio Hagn, «el canal VDAC1 puede considerarse un guardián del equilibrio celular: mientras mantiene su hélice oculta, la célula vive; cuando la expone, la célula muere». Este descubrimiento, concluyen los autores, no solo ilumina un capítulo fundamental de la biología celular, sino que abre la puerta a una nueva generación de terapias que manipulen los resortes moleculares de la vida y la muerte.▪️
TAMBIÉN TE PUEDE INTERESAR:
🔬 Las mitocondrias podrían ser la clave para curar la diabetes
🔬 Las células cerebrales más viejas se aferran con fuerza a la vida antes de morir
🔬 Apoptosis: a process with 1.8 billion year-old origins
🔬 Cómo la inteligencia artificial engaña a las células del cáncer de colon para que se autodestruyan
Información facilitada por la TUM
Fuente: Daniilidis, M., Günsel, U., Broutzakis, G. et al. Structural basis of apoptosis induction by the mitochondrial voltage-dependent anion channel. Nature Communications (2025). DOI: https://doi.org/10.1038/s41467-025-65363-1