Cómo la geometría del embrión dirige el desarrollo de la vida desde la primera célula
Antes incluso de que los genes entren en acción, la forma del embrión ya está tomando decisiones clave para su desarrollo vital. Un nuevo estudio desvela que la geometría de la primera célula organiza el ritmo de las divisiones, la activación genética y el destino final del organismo.
Por Enrique Coperías, periodista científico
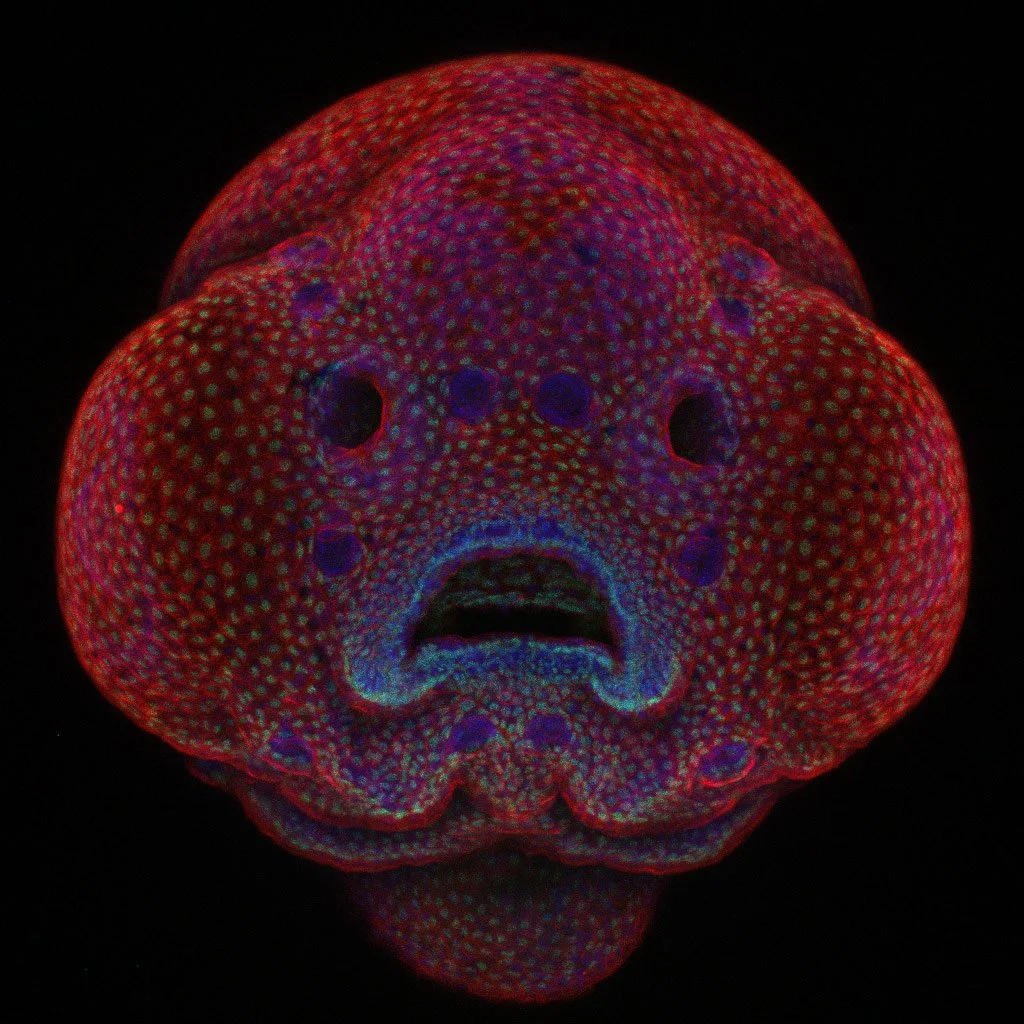
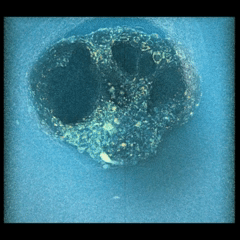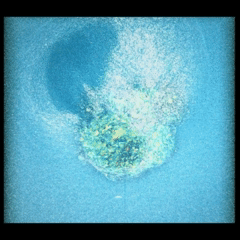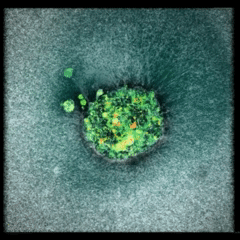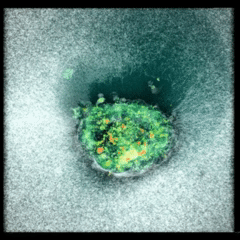
Embrión de pez cebra con cuatro días de edad. Cortesía: Dr. Oscar Ruiz / The University of Texas MD Anderson Cancer Center / https://www.nikonsmallworld.com/
Antes de que existan órganos, tejidos o incluso genes activándose de manera autónoma, la vida ya obedece a una ley silenciosa pero decisiva: la geometría.
La forma inicial del embrión —su curvatura, su volumen, su simetría— no es un simple detalle físico, sino una condición fundamental que organiza el desarrollo de los seres vivos desde el primer instante.
Así lo demuestra un nuevo estudio publicado en la revista Nature Physics, que revela cómo la geometría del embrión del pez cebra (Danio rerio) actúa como un director de orquesta invisible, coordinando las divisiones celulares, el ritmo del ciclo celular y la activación de los primeros genes del organismo.
El pez cebra como modelo para estudiar el origen de la vida
Durante décadas, la biología del desarrollo ha puesto el foco en los genes y las señales moleculares como los grandes arquitectos del embrión. Sin embargo, este trabajo propone un giro conceptual: antes de que la genética tome el control, es la forma física del embrión la que impone un orden.
«La geometría del embrión no es un resultado pasivo del desarrollo, sino una causa activa», sugieren los autores en su artículo en Nature Physics.
El pez cebra es un modelo ideal para estudiar estas primeras etapas del desarrollo. Su embrión es transparente, se desarrolla con rapidez y comparte con otros vertebrados principios fundamentales del desarrollo.
🗣️ «El pez cebra se erige en un organismo ideal para estudiar las primeras etapas del desarrollo —explica Nikhil Mishra, biólogo del Instituto de Ciencia y Tecnología de Austria. Y añade—: Sus embriones se fecundan fuera del cuerpo de la madre, lo que significa que podemos recogerlos y estudiarlos con facilidad, a menudo cientos a la vez. Además, son naturalmente transparentes, de modo que literalmente podemos ver cómo sus células se dividen, se mueven y cambian en tiempo real».
Por qué las células no se dividen todas al mismo tiempo
Tras la fecundación, el embrión comienza una serie de divisiones celulares rápidas llamadas clivajes. Al principio, estas divisiones son casi perfectamente sincronizadas. Pero pronto aparece un fenómeno intrigante: las células dejan de dividirse al mismo tiempo y lo hacen siguiendo un patrón en forma de ola mitótica que se propaga desde el polo animal —la región superior del embrión— hacia el margen, donde el blastodermo —el conjunto de células embrionarias que se forma tras las primeras divisiones del óvulo fecundado y que dará origen a todos los tejidos y órganos del organismo— se encuentra con el vitelo, esto es, la reserva de nutrientes del embrión, una masa rica en sustancias energéticas que alimenta al embrión durante sus primeras etapas de desarrollo, antes de que pueda obtener nutrientes por sí mismo.
🗣️ «Al principio, estas divisiones ocurren rápidamente y sin que las células adopten funciones especiales —señala Mishra—. Pero pronto empiezan a surgir patrones: algunas células se dividen más despacio, otras comienzan a activar genes distintos y otras se desplazan a nuevas posiciones».
Durante años se pensó que esta ola mitótica se debía a señales químicas que viajaban de célula a célula, sincronizando de este modo sus relojes internos. Sin embargo, el nuevo estudio desmonta esa idea en el pez cebra. Mediante experimentos de desincronización artificial y modelos matemáticos, los investigadores muestran que las células no se reenganchan unas a otras. Cada célula sigue su propio reloj. La clave no está en la comunicación, sino en el tiempo.
Nikhil Mishra y Yuting Irene Li, investigadores posdoctorales del Institute of Science and Technology Austria (ISTA), trabajan con embriones de pez cebra, un modelo clave para estudiar cómo la geometría del embrión influye en la división celular y la activación genética durante las primeras etapas del desarrollo. Cortesía: ISTA
El tamaño celular y el ritmo del ciclo celular
Y ese tiempo lo marca el tamaño celular. En efecto, las células más grandes, situadas cerca del polo animal, se dividen ligeramente más rápido que las más pequeñas del margen. La diferencia es mínima —apenas un 2 o 3 % en la duración del ciclo celular—, pero se acumula con cada división.
Como en una carrera de fondo, esas pequeñas ventajas iniciales terminan generando una ola visible de divisiones celulares. La sincronía se pierde de forma gradual, no abrupta, y lo hace siguiendo un patrón espacial reproducible.
Pero ¿por qué unas células son más grandes que otras? Aquí entra en juego la geometría del embrión. En el pez cebra, el embrión temprano no es una esfera perfecta. El blastodisco —la región citoplasmática donde se producen las divisiones— está apoyado sobre el vitelo y presenta una curvatura asimétrica. Esa curvatura condiciona cómo se orientan los husos mitóticos, las estructuras que separan los cromosomas durante la división celular.
Un gradiente de tamaños celulares que afecta a la división del ADN
Según una regla clásica formulada hace más de un siglo, conocida como la regla de Hertwig, las células tienden a dividirse a lo largo de su eje más largo. En el embrión del pez cebra, esa simple ley geométrica basta para explicar un fenómeno complejo: las divisiones no reparten el volumen celular por igual.
La célula hija más cercana al polo animal recibe de forma sistemática más citoplasma que su hermana periférica. División tras división, este sesgo se amplifica y da lugar a un gradiente de tamaños celulares a lo largo del embrión.
Ese gradiente tiene consecuencias profundas. El tamaño de una célula determina la proporción entre el volumen del núcleo y el citoplasma, lo que los biólogos llaman la relación núcleo-citoplasma. Cuando esta relación aumenta, el ciclo celular se ralentiza, especialmente en la fase S, que es en la que se replica el ADN. Así, las células pequeñas del margen entran antes en ese estado de ralentización, mientras que las grandes del polo animal siguen dividiéndose más deprisa durante un tiempo.
🗣️ «Este ciclo repetitivo, conocido como oscilación, varía ligeramente en cada célula en función de su tamaño, que a su vez está determinado por la geometría del óvulo fecundado —explica Yuting Irene Li, experta en dinámica de osciladores. Y continúa—: Como consecuencia, estos distintos “relojes” se alinean siguiendo un patrón que recorre el embrión. Lo que se observa es una ola de fase mitótica: una ola formada porque distintas células alcanzan, una tras otra, el momento de división de sus relojes internos».
Humanos y peces cebra son más parecidos de lo que parece, especialmente en el desarrollo embrionario temprano. Por eso, este organismo se ha convertido en un modelo clave en biología, capaz de revelar principios generales que ayudan a comprender cómo se organizan y desarrollan los embriones en muchas especies. Crédito: ISTA
De la forma del embrión a la activación de los genes
El resultado es un embrión donde el tiempo biológico se organiza en el espacio. La geometría crea diferencias de volumen; el volumen modula el ritmo del ciclo celular; y ese ritmo genera patrones colectivos sin necesidad de coordinación celular directa. Es una coreografía emergente dictada por la forma.
Pero las implicaciones no terminan ahí. El momento en que el embrión empieza a activar su propio genoma —un proceso conocido como activación del genoma cigótico— es uno de los hitos más importantes del desarrollo embrionario. Hasta entonces, el embrión depende del ARN y proteínas maternas heredadas del óvulo. Activar sus propios genes es, en cierto modo, adquirir autonomía embrionaria.
El estudio muestra que esta activación genética tampoco ocurre de forma uniforme. Comienza antes en las células del margen que en las del polo animal, siguiendo el mismo gradiente impuesto por la geometría. Las células más pequeñas y con ciclos celulares más largos son capaces de iniciar la transcripción genética antes, probablemente porque disponen de más tiempo entre divisiones para hacerlo.
Qué ocurre cuando se altera la geometría del embrión
Cuando los investigadores alteran experimentalmente la forma del embrión —por ejemplo, creando embriones con dos polos animales o modificando la curvatura del blastodisco—, el patrón se rompe. Aparecen dos olas mitóticas en lugar de una. La activación genética se vuelve errática. Y, más adelante, se observan errores en la especificación de las capas germinales, los tejidos primordiales de los que surgirán órganos y estructuras.
En cerca de un tercio de estos embriones alterados, aparecen células que adoptan destinos celulares incorrectos, como si la brújula del desarrollo se hubiera desorientado. La forma inicial del embrión, concluyen los autores, no solo organiza el tiempo y la división celular, sino que prepara el terreno para que las señales genéticas posteriores actúen de manera robusta y fiable.
El hallazgo tiene implicaciones que van más allá del pez cebra. Otros organismos, desde gusanos hasta anfibios, muestran alineaciones similares entre ejes geométricos, tamaño celular y destino celular. La idea de que la forma precede a la función, tan familiar en la arquitectura o la física, emerge aquí como un principio biológico fundamental.
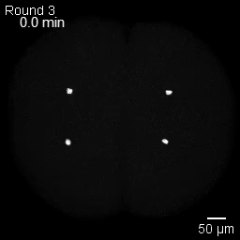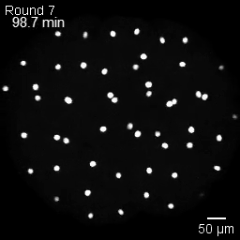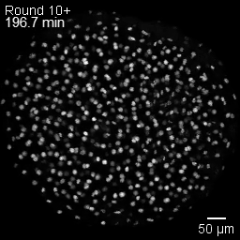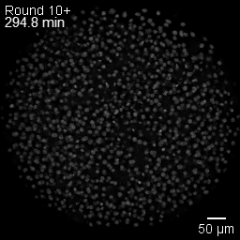
Una «ola de estadio» microscópica
Las células en división de un embrión se organizan en olas de fase mitótica, un patrón colectivo en el que cada célula alcanza el momento de dividirse de forma secuencial, guiada por su tamaño y por la geometría del embrión. Cortesía: ©Mishra et al. / Nature Physics
Implicaciones para la reproducción asistida y la FIV
En un momento en que la biología tiende a descomponer la vida en redes de genes y moléculas, este trabajo recuerda que la materia viva también obedece a leyes físicas simples. Que la geometría, lejos de ser un mero escenario, puede ser una fuerza organizadora. Y que, quizá, la primera decisión del desarrollo no esté escrita en el ADN, sino en la forma misma del embrión.
🗣️ «A partir de lo que comienza como un conjunto simple y aparentemente idéntico de células, va tomando forma gradualmente un embrión estructurado y organizado, que sienta las bases de todo el plan corporal», resume Mishra.
Y concluye con una mirada hacia la biomedicina reproductiva: «Muchos embriones que fracasan durante el desarrollo muestran anomalías en los primeros patrones de división celular o en la forma en que activan sus genes, pero todavía no entendemos del todo por qué. Nuestro trabajo sugiere que la geometría del embrión temprano —la forma física y la disposición de sus primeras células— puede desempeñar un papel importante para que el desarrollo embrionario siga el camino correcto».▪️
Información facilitada por el ISTA
Fuente: Mishra, N., Li, Y.I., Hannezo, E. et al. Geometry-driven asymmetric cell divisions pattern cell cycles and zygotic genome activation in the zebrafish embryo. Nature Physics (2026). DOI: https://doi.org/10.1038/s41567-025-03122-1