Desarrollan embriones humanos «sintéticos» que fabrica su propia sangre
Investigadores de Cambridge crean un modelo de embrión humano, equiparable a uno de entre cuatro y seis semanas, que genera células madre sanguíneas de forma espontánea. Bautizado como «hemaotide», este hito biomédico supone un avance que redefine la biología del desarrollo y la medicina regenerativa.
Por Enrique Coperías
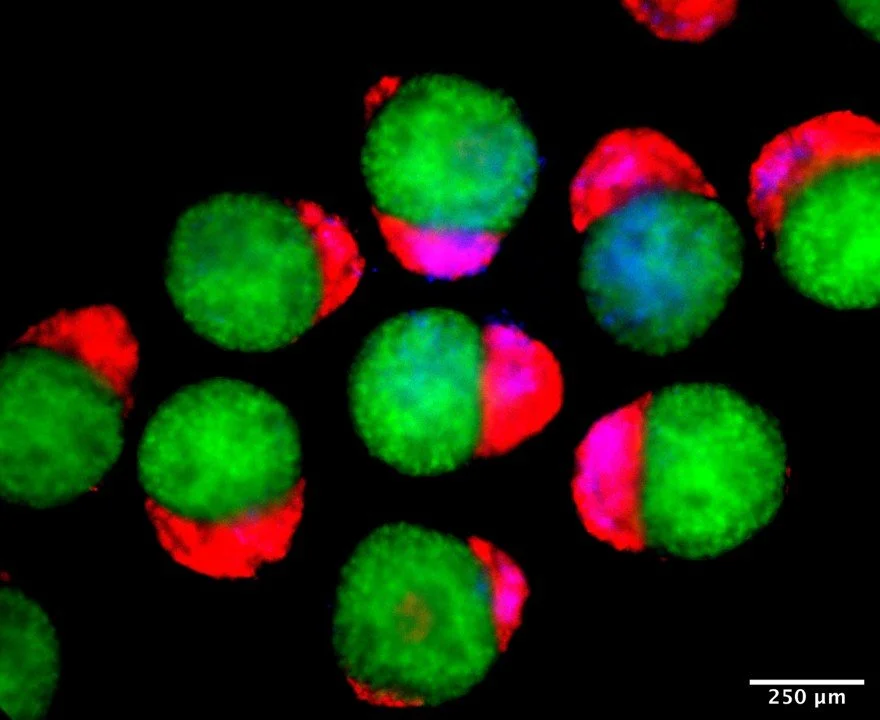
Los investigadores han observado bajo la luz del microscopio cómo las estructuras tridimensionales similares a embriones comienzan a producir sangre (en rojo) tras unas dos semanas de desarrollo, imitando el proceso natural en los embriones humanos. Cortesía: Jitesh Neupane / University of Cambridge
Por primera vez, un grupo de científicos ha conseguido recrear en el laboratorio un modelo de embrión humano capaz de generar sus propias células sanguíneas. El hallazgo, publicado en la revista Cell Reports, supone un paso decisivo hacia la comprensión de cómo se forma la sangre en las primeras semanas de vida. Además podría allanar el camino para fabricar células madre hematopoyéticas, las células que regeneran toda la sangre del cuerpo, sin necesidad de donantes.
El estudio, liderado por Jitesh Neupane y M. Azim Surani, del Instituto Gurdon, en la Universidad de Cambridge, presenta un modelo tridimensional derivado de células madre humanas que imita el desarrollo embrionario tras la gastrulación, una etapa crucial que ocurre poco después de la implantación del embrión en el útero. Los autores han bautizado a estas estructuras como hematoides, por su capacidad de producir células de la sangre y organizar tejidos comparables a los de un embrión humano de entre cuatro y seis semanas.
«Fue un momento emocionante cuando apareció el color rojo de la sangre en la placa: era visible incluso a simple vista —recuerda Neupane, primer autor del estudio, al describir la primera vez que observaron cómo los hematoides comenzaban a generar células sanguíneas de forma espontánea. Y añade—: Nuestro nuevo modelo imita el desarrollo de la sangre fetal humana en el laboratorio. Esto arroja luz sobre cómo se forman naturalmente las células sanguíneas durante la embriogénesis humana, y ofrece posibles avances médicos para probar fármacos, estudiar el desarrollo temprano de la sangre y del sistema inmunitario, y modelar trastornos sanguíneos como la leucemia».
Cómo se desarrollan los hematoides
El experimento parte de células madre pluripotentes humanas —capaces de transformarse en cualquier tipo celular— cultivadas en condiciones diseñadas para imitar el entorno del embrión en sus primeros estadios. Mediante una secuencia controlada de señales químicas y un sistema de cultivo rotatorio, los investigadores observaron cómo los agregados celulares se autoorganizaban en estructuras alargadas que, en pocos días, comenzaron a latir y mostraron zonas rojizas bajo el microscopio.
Estas áreas del color de la sangre resultaron ser focos de intensa actividad hematopoyética. Las células de los hematoides expresaban marcadores típicos de los precursores sanguíneos, y, al analizarlas individualmente mediante secuenciación de ARN, se comprobó que seguían las mismas rutas de diferenciación que las células madre hematopoyéticas (HSC) que surgen en el embrión humano real, en una región conocida como aorta-gónada-mesonefros (AGM). Es allí donde, hacia la quinta semana de gestación, nacen las primeras células madre definitivas capaces de regenerar toda la sangre adulta.
Los hematoides no solo generaron células endoteliales, sino que dentro de ellas se observó un proceso clave: la transición endotelio-hematopoyética (EHT), mediante la cual algunas células del endotelio se transforman en células madre de la sangre. Este fenómeno, muy difícil de estudiar en humanos, se reprodujo espontáneamente en el modelo, sin añadir citoquinas ni factores de crecimiento externos.
«Este modelo ofrece una nueva y poderosa forma de estudiar el desarrollo de la sangre en el embrión humano temprano —destaca el profesor Azim Surani, investigador principal del Instituto Gurdon y pionero en biología del desarrollo humano. Y añade—: Aunque todavía está en sus primeras fases, la capacidad de producir células sanguíneas humanas en el laboratorio representa un paso importante hacia futuras terapias regenerativas —que utilicen las propias células del paciente para reparar y regenerar tejidos dañados».
«Fue sorprendente ver que la maduración de las células madre ocurría de forma autónoma, impulsada por señales internas del propio nicho hemogénico —comenta Surani—. Esto indica que el entorno tisular es suficiente para desencadenar la hematopoyesis definitiva».
La sangre sin saco vitelino
A diferencia de otros modelos de embrión o de los sistemas de cultivo clásicos, los hematoides no desarrollan un saco vitelino, la estructura extraembrionaria donde se produce la llamada hematopoyesis primitiva, responsable de los primeros glóbulos rojos transitorios. En su lugar, las células sanguíneas se originan dentro del propio tejido embrionario, y reflejan la hematopoyesis definitiva que da lugar a las células madre duraderas y a los linajes mieloides y linfoides.
El equipo comprobó que las células generadas en los hematoides expresaban tanto hemoglobinas embrionarias como fetales y adultas, lo que sugiere una transición natural entre las fases tempranas y maduras del desarrollo sanguíneo. Además, en ensayos de cultivo con organoides intestinales humanos, las células madre extraídas de los hematoides fueron capaces de diferenciarse en linfocitos T, células NK y monocitos, un repertorio característico de la hematopoyesis definitiva.
En conjunto, el modelo reproduce un estadio equivalente a los embriones humanos entre los estadios de Carnegie 12 y 16, cuando comienzan a formarse el corazón, el hígado y los vasos principales.
El nicho hemogénico: una fábrica de sangre en miniatura
Los investigadores también descubrieron que el desarrollo de las células sanguíneas depende en última instancia de un microambiente especializado dentro del hematoide. En los agregados más maduros, se formaban brotes hemogénicos, pequeñas protuberancias ricas en colágeno y fibronectina donde se concentraban las células positivas para SOX17 y RUNX1, dos proteínas clave en la transición hacia la hematopoyesis.
Estas estructuras se asemejan al nicho de la aorta-gónada-mesonefros del embrión, donde las células endoteliales hemogénicas se convierten en precursores hematopoyéticos.
El equipo demostró que la aparición de estos nichos depende del momento preciso en que se inhibe la señal del factor de crecimiento TGF-β1, una molécula implicada en múltiples vías del desarrollo. Si la inhibición se aplicaba demasiado pronto, los agregados producían tejidos neuronales y musculares, pero no células de la sangre.
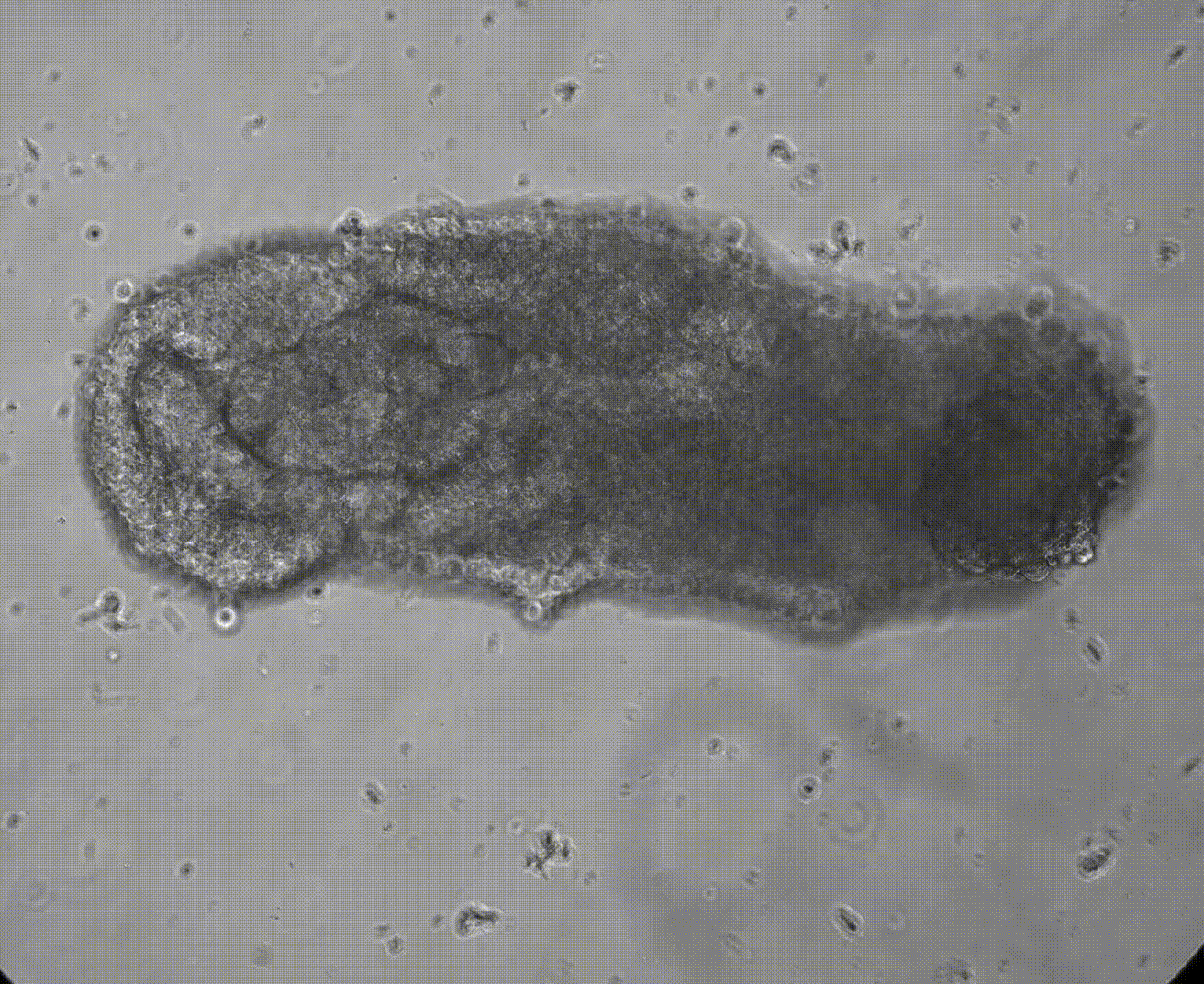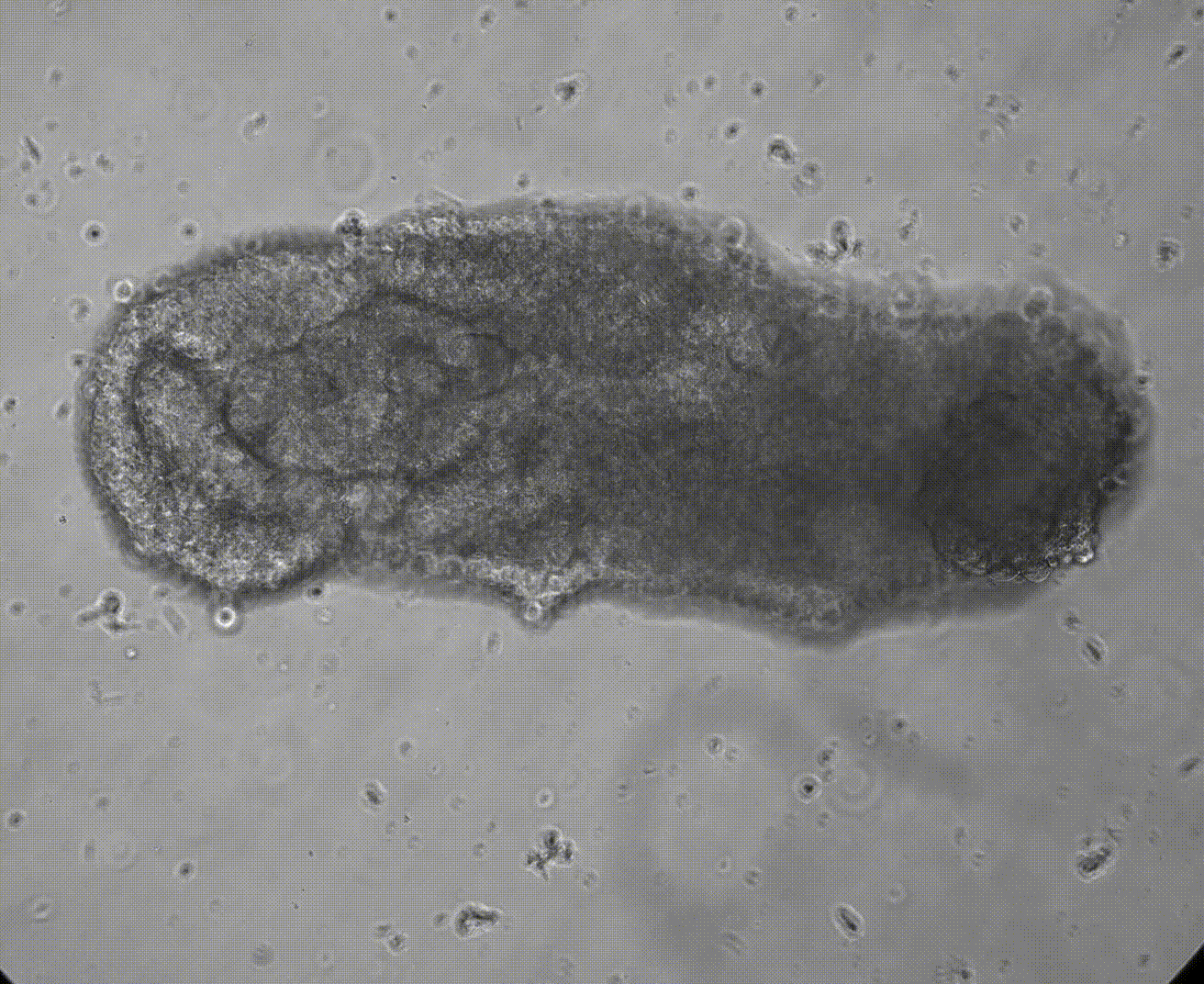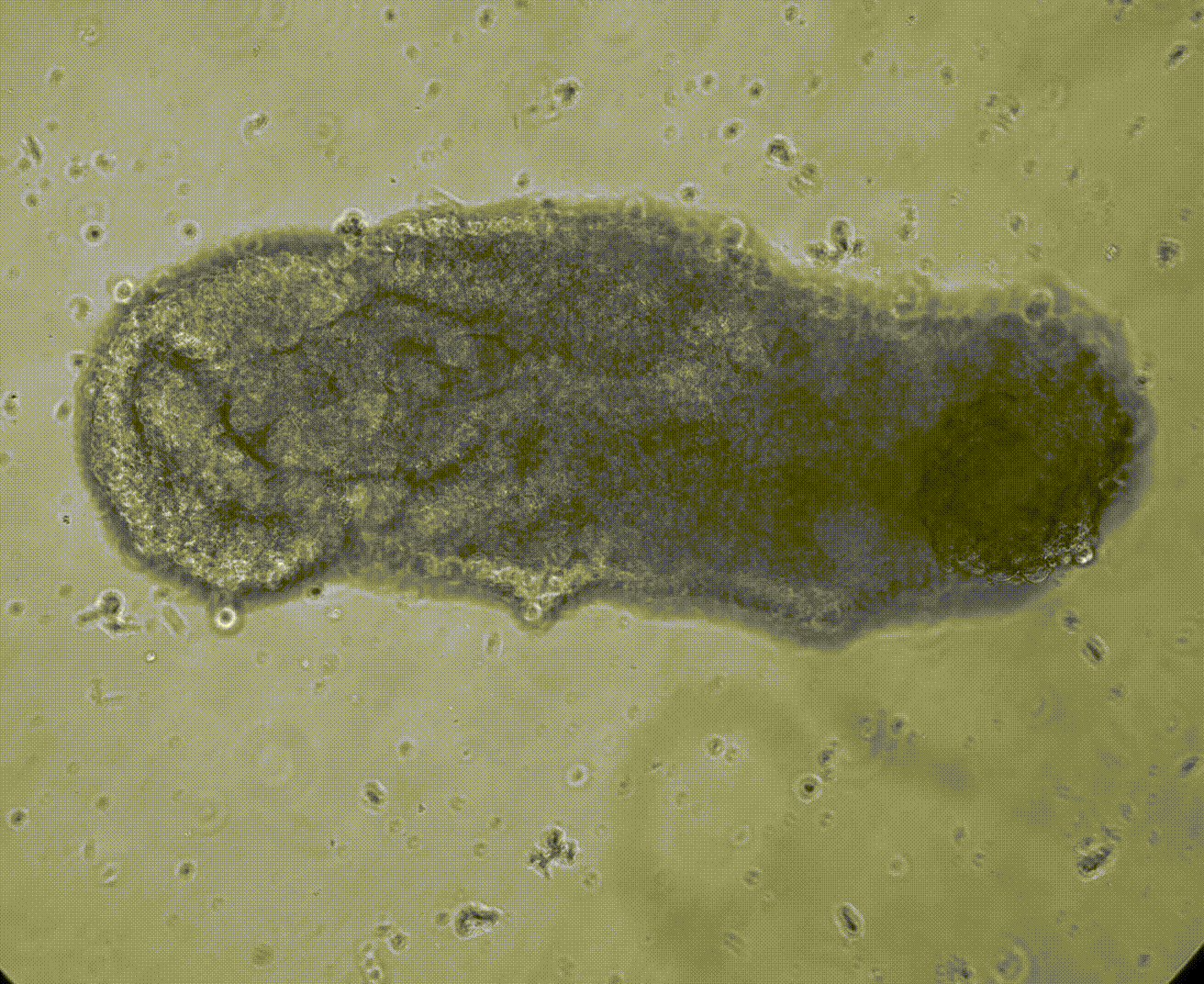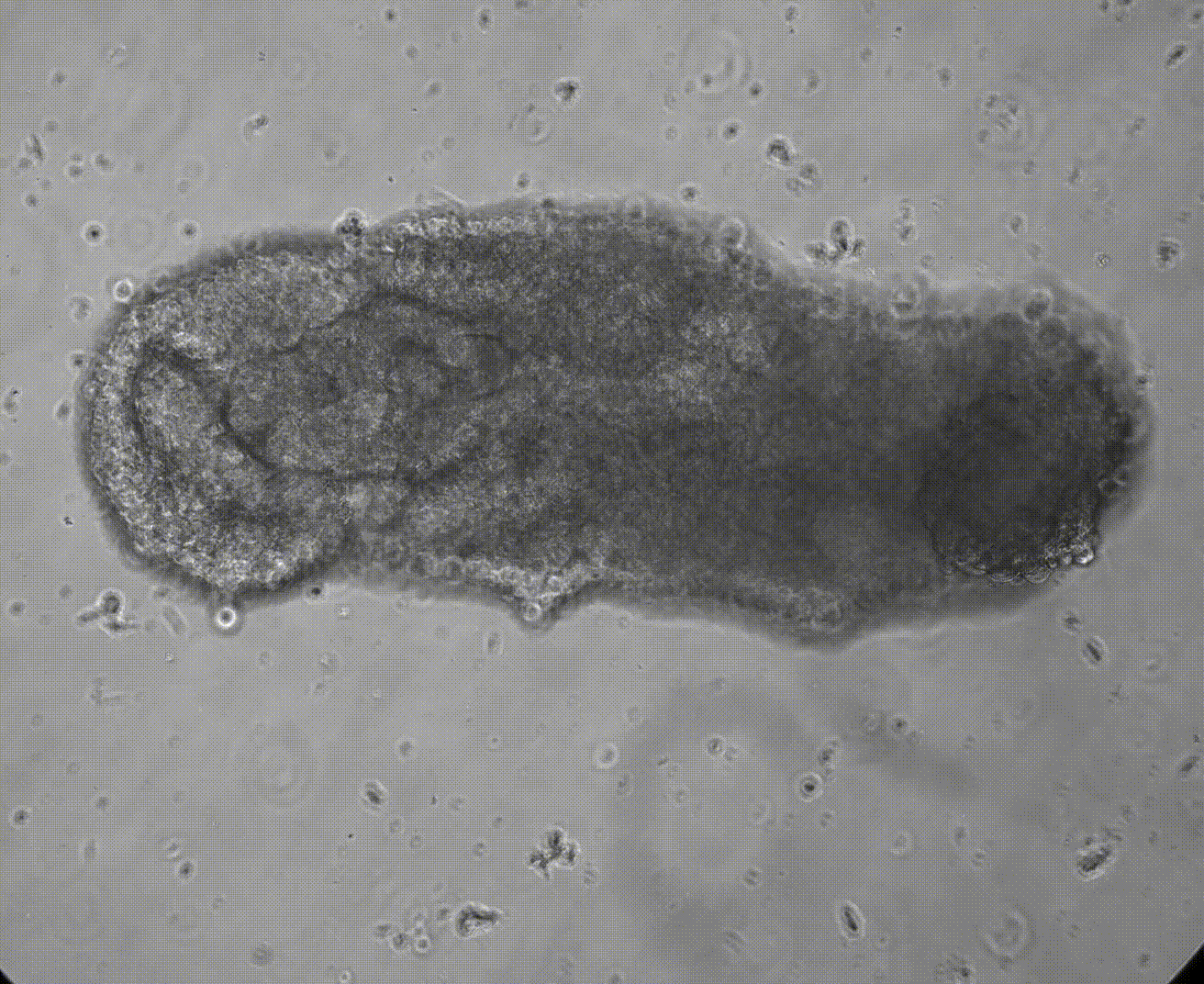
El equipo observó al microscopio cómo los hematoides tridimensionales se autoorganizaban en solo unos días en tres capas germinales —ectodermo, mesodermo y endodermo—, las bases del plan corporal humano a partir de las cuales se forman todos los órganos y tejidos, incluida la sangre. Cortesía: Jitesh Neupane / University of Cambridge
Para el estudio del cáncer de sangre
En cambio, cuando la supresión se iniciaba tras la gastrulación, emergían los nichos hemogénicos y la hematopoyesis florecía. «Existe una ventana temporal muy específica para que el mesodermo lateral, origen de las células sanguíneas y vasculares, se diferencie correctamente”, explica Neupane.
La coautora Geraldine Jowett destaca otro aspecto fundamental del hallazgo: «Los hematoides reproducen la segunda ola del desarrollo sanguíneo, capaz de generar células inmunitarias especializadas o linfocitos adaptativos, como las células T. Esto abre vías muy prometedoras para utilizarlos en el estudio tanto del desarrollo normal como del canceroso de la sangre».
El estudio también identificó varios factores moleculares que regulan este proceso. Entre ellos, la proteína FGF23, que en exceso inhibe la formación del nicho, y la DLL4, un componente de la vía Notch que actúa como un interruptor molecular que decide si una célula permanece madre o se especializa. Al bloquear la DLL4 o la señal del receptor c-KIT —clave para la supervivencia de las células madre—, los hematoides perdieron su capacidad de generar sangre, lo que confirma que estas rutas son esenciales para mantener la hematopoyesis en su contexto natural.
Implicaciones para la medicina regenerativa
Más allá del avance científico, el modelo tiene implicaciones potenciales para la medicina regenerativa. Las células madre hematopoyéticas humanas son esenciales para los trasplantes de médula ósea, pero su obtención sigue dependiendo de donantes y presenta riesgos de rechazo. Si los hematoides pueden producir células madre hematopoyéticas funcionales y compatibles con cada paciente, se abriría la posibilidad de terapias personalizadas para enfermedades como la leucemia, la anemia de Fanconi o las inmunodeficiencias congénitas.
Sin embargo, los autores insisten en que el objetivo inmediato no es crear fuentes de sangre para trasplantes, sino entender los mecanismos de la hematopoyesis humana en un entorno controlado.
«Este modelo nos permite observar, con un nivel de detalle sin precedentes, cómo el embrión humano genera su sistema sanguíneo —señala Surani—. Eso podría ayudarnos a corregir defectos congénitos o a mejorar la producción de células madre in vitro».
Limitaciones éticas
El trabajo también se sitúa en el contexto más amplio del floreciente campo de los modelos de embriones sintéticos, construidos a partir de células madre sin emplear óvulos ni espermatozoides. En los últimos años, varios grupos han logrado reproducir etapas previas, como los blastoides o los gastruloides, que simulan el embrión antes y durante la gastrulación.
Los hematoides, en cambio, representan una fase más avanzada, tras la implantación, cuando comienzan a formarse los órganos principales.
La investigación fue revisada por comités éticos y se ajusta a las directrices internacionales que limitan el cultivo de embriones humanos más allá de los catorce días. Los hematoides no poseen tejidos extraembrionarios ni la capacidad de desarrollarse completamente, por lo que no se consideran embriones viables. Aun así, su desarrollo plantea nuevos debates sobre los límites de la experimentación y la necesidad de actualizar los marcos regulatorios a medida que los modelos se vuelven más complejos.
Vídeo de un hematoide. Cortesía: Jitesh Neupane / University of Cambridge
Un espejo del desarrollo humano en sus etapas iniciales
Para los especialistas, los hematoides representan un espejo del embrión temprano: una herramienta para explorar procesos invisibles dentro del útero. El hecho de que generen de forma espontánea un nicho hematopoyético funcional demuestra que las células madre humanas conservan una sorprendente capacidad de autoorganización. Además, el modelo ofrece un banco de pruebas para estudiar cómo distintas señales químicas, genes o fármacos afectan al desarrollo de la sangre y otros tejidos.
«El trabajo de Neupane y Surani sitúa a los modelos de embrión humano en una nueva dimensión —opina un investigador no vinculado al estudio—. “Ya no se trata solo de reproducir la arquitectura del embrión, sino de capturar funciones dinámicas, como el latido del corazón o la producción de sangre».
Los autores reconocen que el modelo aún tiene limitaciones. No incluye tejidos neurales ni somitas (estructuras segmentadas que se forman a partir del mesodermo durante el desarrollo embrionario, situadas a ambos lados del tubo neural), y la eficiencia de formación de los hematoides varía entre líneas celulares. Aun así, su reproducibilidad es suficiente para realizar estudios a gran escala.
«Podemos generar cientos de hematoides y analizar cómo cambian sus propiedades bajo diferentes condiciones —señala Neupane—. Eso nos da una ventana experimental única al inicio del desarrollo humano».
En definitiva, los hematoides no son embriones humanos, pero sí un reflejo fiel de algunos de sus procesos más esenciales. Su capacidad para generar células madre de la sangre sin manipulación genética ni factores externos marca un hito en la biología del desarrollo y abre nuevas vías para comprender —y tal vez replicar— el misterioso instante en que, por primera vez, la vida humana empieza a fabricar su propia sangre. ▪️
TAMBIÉN TE PUEDE INTERESAR:
🧫 Un avance clave hacia la producción de sangre artificial: descubren la señal que desencadena la maduración de glóbulos rojos
🧫 Los donantes de sangre experimentan cambios genéticos beneficiosos
🧫 Graban por primera vez la implantación de un embrión humano en 3D y en tiempo real
Información facilitada por la Universidad de Cambridge
Fuente: Neupane, Jitesh et al. A post-implantation model of human embryo development includes a definitive hematopoietic niche. Cell Reports (2025). DOI: 10.1016/j.celrep.2025.116373