Descubren que las células «vomitan» para curar las heridas
Cuando las células sufren una lesión, no solo reciclan su interior: también pueden «vomitar» sus propios desechos en un sorprendente proceso de purga llamado catartocitosis. Este descubrimiento saca a la luz un atajo biológico con doble filo: acelera la reparación de tejidos dañados, pero también puede abrir la puerta a la inflamación crónica y al cáncer gástrico.
Por Enrique Coperías
Ilustración tipo cómic de la catartocitosis, el proceso recientemente descrito en el que las células “vomitan” sus propios desechos para poder regenerarse tras una lesión. Esta purga celular, observada en el estómago de ratones, acelera la reparación de los tejidos, aunque también puede favorecer la inflamación crónica y el desarrollo de cáncer gástrico. Imagen generada con DALL-E
En la vida cotidiana, el vómito suele asociarse con enfermedad o con una reacción violenta del cuerpo frente a algo que lo irrita o considera dañino. Ahora bien, ¿y si las propias células tuvieran un mecanismo semejante para sobrevivir a las lesiones?
Esa es precisamente la metáfora que los científicos utilizan para describir un hallazgo inesperado: las células pueden expulsar directamente parte de sus orgánulos y proteínas sobrantes hacia el exterior, en un proceso que acelera la reparación de los tejidos.
El fenómeno, identificado en un estudio con ratones y descrito por primera vez por investigadores de la Washington University School of Medicine en St. Louis y del Baylor College of Medicine, ha recibido el nombre de catartocitosis. El término, derivado del griego, significa purga celular o limpieza celular.
Los resultados del descubrimiento, publicados en la revista Cell Reports, no solo arrojan nueva luz sobre cómo se regeneran los tejidos y órganos tras sufrir una lesión, sino que también sugieren vínculos con procesos patológicos de gran relevancia, como son la inflamación crónica y la formación de tumores digestivos.
Paligenosis: células maduras que viajan en el tiempo
Cuando un tejido se daña, las células pueden optar por diferentes soluciones para atajar el problema. En tejidos con abundante células madre, que poseen el don de poder transformarse en distintos tipos de células especializadas (como musculares, nerviosas o sanguíneas), son estas las que proliferan para reemplazar lo perdido. Pero si las células madre faltan o están dañadas, el rescate recae en las células maduras y especializadas.
Aquí entra en juego un proceso bien conocido por los biólogos: la paligenosis, la capacidad de esas células maduras de literalmente «volver atrás en el tiempo» y reprogramarse a un estado inmaduro parecido al de las células progenitoras, capaces de dividirse y regenerar los tejidos.
El problema es que una célula especializada está llena de maquinaria diseñada para una función muy concreta; por ejemplo, las células principales del estómago tiene diseñada su fábrica interna para producir enzimas digestivas. Esa infraestructura es inútil para la tarea de regenerar y, además, ocupa un espacio y consume recursos que impiden aligerar y reiniciar el ciclo celular.
Un vómito celular
Hasta ahora se pensaba que la solución consistía únicamente en autofagia, que no es otra cosa que la degradación controlada de los componentes internos por parte de los lisosomas —orgánulos que funcionan como su sistema de reciclaje—, un proceso lento pero ordenado. Sin embargo, el nuevo estudio revela que existe una vía alternativa, más rápida y radical: la catartocItosis, que permite expulsar de golpe hacia el exterior el material sobrante.
«Después de una lesión, la misión de la célula es reparar el daño. Pero su maquinaria madura estorba —explica el primer autor Jeffrey W. Brown, profesor de Medicina en la Universidad de Washington. Y añade—: Esta purga celular es una forma rápida de deshacerse de esa maquinaria y convertirse en una célula pequeña y primitiva capaz de proliferar y reparar los daños».
Brown compara el fenómeno con «un vómito celular», un atajo que ayuda a despejar espacio y centrarse en la tarea urgente de regenerar tejido sano.
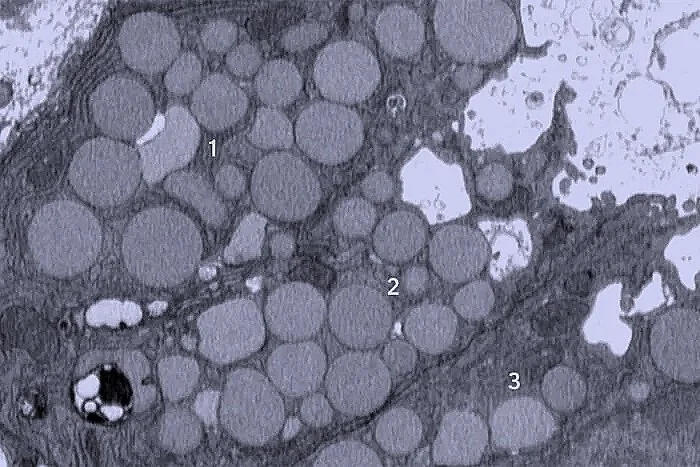
En la imagen, tres células gástricas de ratón expulsan restos a través de cavidades blancas en sus membranas mediante catartocitosis. Cortesía: Jeffrey Brown
Cómo se descubrió la purga celular
El hallazgo de esta pota biológica fue casi accidental. El equipo de Brown y su colega Jason C. Mills, hoy en el Baylor College of Medicine, llevaba años estudiando la paligenosis. En 2018 ya habían descrito este mecanismo de reprogramación celular. Pero en sus modelos de lesión gástrica con ratones comenzaron a notar algo extraño: restos de desechos en el exterior de las células.
Al principio pensaron que era un artefacto del ensayo o una rareza, pero cuanto más repetían los experimentos, más evidente resultaba que aquel desparrame no era casual. Gracias a un modelo de lesión inducida en el estómago que sincroniza la reprogramación celular de miles de células a la vez, los investigadores observaron que la expulsión de material se producía de manera coordinada.
No era, por tanto, una anomalía: se trataba de una nueva forma de respuesta celular estándar. Con potentes técnicas de microscopía tridimensional, lograron reconstruir cómo las células formaban invaginaciones complejas en la membrana apical a modo de compartimentos de expulsión. Por esos canales, se arrojaban fragmentos de retículo endoplasmático, gránulos de secreción y glicoproteínas sulfatadas.
El nombre catartocitosis vino después, como una manera de resaltar que lo observado era una catarsis celular: una purga necesaria para renacer.
Ventajas y riesgos de la purga celular
Este mecanismo celular recién descubierto tiene claras ventajas. Al actuar más rápido que la autofagia, permite que las células se reinicien en cuestión de horas y puedan contribuir a la regeneración del tejido lesionado con mayor celeridad.
Pero, como en muchos atajos, la rapidez se paga con desorden. «La catartocitosis es veloz pero desordenada, lo que puede ayudar a explicar cómo la respuesta a una lesión puede salir mal, sobre todo en escenarios de daño crónico» advirtie Brown.
Su colega Mills es aún más claro: «En estas células gástricas, revertir al estado de célula madre es un proceso arriesgado, especialmente ahora que hemos identificado esta purga potencialmente inflamatoria en su interio».
El problema es que, a diferencia de la digestión ordenada dentro de un lisosoma, la expulsión masiva de restos celulares deja un festín de desechos celulares en el entorno del tejido. Ese material puede alimentar la inflamación crónica, un caldo de cultivo ideal para la acumulación de mutaciones y, en última instancia, para la aparición de cáncer gástrico.
Las células del estómago son longevas y acumulan daños en su ADN con la edad. Si una célula con mutaciones vuelve a un estado progenitor gracias a la paligenosis, y además lo hace en un entorno inflamado y lleno de desechos, el riesgo de que esas mutaciones prosperen se multiplica peligrosamente.
De la regeneración al tumor gástrico
Los investigadores creen que este hallazgo puede ayudar a explicar la relación entre las infecciones crónicas, la inflamación y el cáncer gástrico.
Un ejemplo claro es la infección por Helicobacter pylori, una bacteria que coloniza el estómago de millones de personas en el mundo. Se sabe que esta infección bacteriana causa inflamación persistente, úlceras y aumenta el riesgo de que aparezca un cáncer de estómago. Ahora, la catartocitosis podría ser parte del engranaje que conecta esos puntos: cada intento de reparación celular mediante purga celular deja restos que perpetúan la inflamación, favoreciendo así un círculo vicioso.
«Si muchas células envejecidas y mutadas intentan regresar a un estado de célula madre para reparar una lesión —y esas lesiones además fomentan la inflamación—, el riesgo de expandir mutaciones dañinas que conduzcan a cáncer se dispara», resume Mills.
Una oportunidad para detectar y tratar el cáncer
Más allá de los riesgos, el hallazgo también abre nuevas posibilidades clínicas. Brown, junto con su colega el gastroenterólogo Koushik K. Das, ha desarrollado un anticuerpo capaz de unirse a fragmentos del material expulsado en la catartocitosis. Esto significa que podría convertirse en una herramienta de diagnóstico para detectar cuándo y dónde está ocurriendo este proceso vomitivo en grandes cantidades.
Así, la catartocitosis podría servir como un biomarcador de estados precancerosos, lo que permitiría identificar lesiones gástricas antes de que evolucionen a tumores digestivos.
«Si entendemos mejor este proceso, podríamos diseñar formas de potenciar la respuesta de curación y, en el contexto de lesiones crónicas, bloquear que las células dañadas que pasan por catartocitosis contribuyan a la aparición de un cáncer», señala Brown.
¿Solo en el estómago?
Aunque la investigación se centró de manera exclusiva en las células gástricas, los autores sospechan que el mecanismo no se limita al estómago. La paligenosis es un programa que se ha conservado en la evolución y que ocurre en diversos órganos y especies.
Por tanto, la catartocitosis podría ser una estrategia bastante extendida de reprogramación celular en distintos contextos, quizá incluso fuera del aparato digestivo.
La pregunta pues queda abierta: ¿es esta purga celular una rareza local, restringida a los límites del estómago o un mecanismo universal de regeneración celular?
Una metáfora de la resiliencia biológica
En definitiva, lo que este descubrimiento ilustra es la resiliencia sorprendente de la biología celular. Las células, enfrentadas a una lesión, no dudan en tomar medidas extremas: expulsar parte de sí mismas para sobrevivir y contribuir a la reparación del tejido.
En palabras de Brown, el precio puede ser alto —inflamación, riesgo de cáncer—, pero también es un recordatorio de que la vida, en todas sus escalas, recurre a estrategias inesperadas para persistir.
Que en pleno 2025 se identifique un proceso celular nuevo demuestra que aún estamos lejos de agotar los secretos de la célula. La catartocytosis entra en escena como un nuevo término en el diccionario de la biología, con resonancias tan gráficas como profundas: la purga que da una segunda oportunidad.
«Este proceso es un atajo para la curación, pero como todo atajo, puede salir mal. Si aprendemos a manejarlo, quizá podamos guiar a las células hacia la regeneración sana y evitar que tomen el camino hacia el cáncer», concluye Brown. ▪️
Información facilitada por la WashU Medicine
Fuente: Brown, Jeffrey W. et al. Cathartocytosis: Jettisoning of cellular material during reprogramming of differentiated cells. Cell Reports (2025). DOI: 10.1016/j.celrep.2025.116070