Los virus gigantes de ADN desarrollan su propio sistema de traducción de proteínas similar al de las células
Un descubrimiento científico desafía la idea de que los virus dependen por completo de las células para fabricar proteínas. Los virus gigantes de ADN han desarrollado su propia maquinaria de traducción, un rasgo clave de la vida que creíamos exclusivo de los organismos celulares.
Por Enrique Coperías, periodista científico
Virus gigantes humanizados toman el control de la maquinaria celular y construyen su propio sistema de traducción para fabricar proteínas virales, en una ilustración inspirada en el nuevo hallazgo científico. Crédito: IA-DALL-E-RexMolón Producciones
Desde que el microbiólogo neerlandés Martinus Beijerinck descubrió el primer virus en 1899, estos agentes infecciosos han ocupado un lugar ambiguo en el mapa de la vida. No son células, no se reproducen por sí solos y dependen de un huésped para multiplicarse.
Sin embargo, los llamados virus gigantes —algunos con genomas tan grandes como los de bacterias— llevan años erosionando esa frontera conceptual. Ahora, un estudio publicado en la revista Cell añade una pieza clave al rompecabezas de la vida: ciertos virus gigantes de ADN no solo manipulan la maquinaria celular de su hospedador, sino que han desarrollado su propio sistema de traducción de proteínas, sorprendentemente similar al de las células eucariotas.
El hallazgo obliga a replantear la clásica distinción entre organismos vivos y entidades acelulares. También sugiere que los virus han desempeñado un papel más activo en la evolución de los mecanismos fundamentales de la vida de lo que se creía hasta ahora.
La traducción de proteínas, el corazón de la vida
Todas las formas de vida conocidas dependen de un proceso central: la traducción de la información genética en proteínas. En las células eucariotas, desde las amebas hasta nosotros mismos, esta tarea se inicia gracias a un complejo molecular denominado eIF4F (factor de iniciación eucariota 4F). Este conjunto de proteínas reconoce el extremo inicial del ARN mensajero (mRNA), recluta ribosomas y pone en marcha la síntesis de proteínas.
Recordemos que el ARN mensajero (mRNA) es una molécula que lleva la información genética del ADN desde el núcleo celular hasta los ribosomas, donde se utiliza como plantilla para fabricar proteínas.
Hasta ahora, el dogma estaba claro: los virus carecen de maquinaria propia para fabricar proteínas y dependen por completo de la célula infectada. Aunque muchos virus codifican enzimas para copiar su ADN o transcribirlo en ARN, la traducción de proteínas se consideraba un monopolio celular.
El nuevo trabajo desafía esa idea. Los investigadores han descubierto que varios virus gigantes de ADN poseen genes que codifican un complejo de iniciación de la traducción análogo al eIF4F eucariota. Este sistema viral, denominado vIF4F, resulta ser funcional y esencial para la producción de proteínas virales.
La conclusión es contundente: algunos virus han desarrollado su propia versión de una de las herramientas más fundamentales de la biología.
¿Qué han descubierto los investigadores?
Max Fels, del Harvard Medical School, y sus colegas del Dana-Farber Cancer Institute en Boston y la Universidad de Aix-Marsella (Francia) pusieron el foco en los llamados virus gigantes, un grupo de virus descubierto en las dos últimas décadas y que ha revolucionado la virología. Estos virus infectan sobre todo a organismos unicelulares como las amebas y pueden contener miles de genes, muchos de ellos sin equivalente claro en otros virus.
En particular, los científicos analizaron el mimivirus, uno de los virus gigantes mejor conocidos. Mediante técnicas de biología molecular y biología estructural, identificaron tres proteínas virales con similitud funcional a las que forman el complejo eIF4F en las células eucariotas.
Estas proteínas virales, equivalentes a la eIF4E, la eIF4G y la eIF4A, se ensamblan en un complejo propio, el vIF4F, que se asocia con los ribosomas de la célula infectada. Su función es iniciar la traducción de proteínas virales, o sea, el proceso por el que la célula infectada fabrica proteínas del virus a partir de su material genético, especialmente en fases tardías de la infección, cuando el virus necesita sintetizar grandes cantidades de componentes estructurales para formar nuevas partículas virales o viriones.
Cuando los investigadores eliminaron los genes del vIF4F, la replicación viral se desplomó. Sin ese sistema, los virus apenas podían producir nuevas partículas, lo que demuestra que su maquinaria de traducción no es un accesorio, sino un elemento esencial.
Un interruptor molecular para dominar la célula
El descubrimiento va más allá de la simple existencia de proteínas virales parecidas a las celulares. El estudio revela que el vIF4F actúa como un interruptor molecular que cambia la prioridad de la célula: de producir proteínas propias a fabricar proteínas virales.
En condiciones normales, la célula utiliza su propio complejo eIF4F para traducir sus mRNA. Pero durante la infección por virus gigantes, el complejo viral sustituye al celular en los ribosomas. Así, el virus redirige la maquinaria de síntesis proteica hacia sus propios genes.
Este cambio no es indiscriminado. El vIF4F reconoce de forma preferente los mRNA virales gracias a una modificación química específica: una adenosina metilada en una posición concreta del extremo inicial del ARN. Esa modificación actúa como una etiqueta molecular o farolillo que permite al complejo viral distinguir los mensajes genéticos del virus de los de la célula huésped.
De este modo, el virus logra un control selectivo sobre la traducción de proteínas. Las proteínas estructurales necesarias para construir nuevas partículas virales se producen en grandes cantidades, mientras que muchas proteínas celulares dejan de sintetizarse.
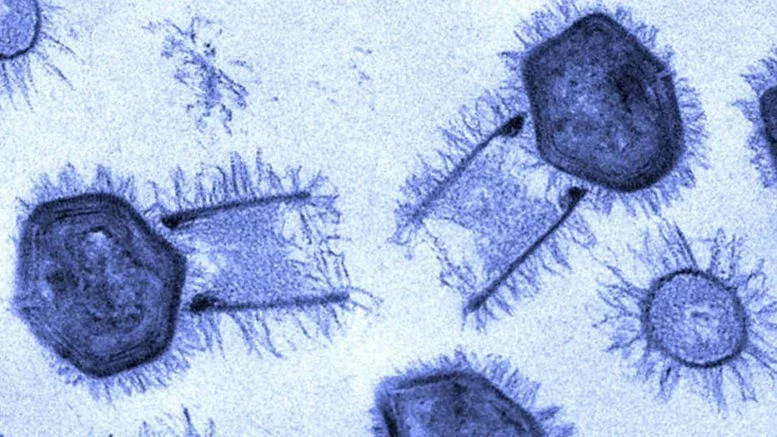
Los virus gigantes, capaces de sobrevivir miles de años y superar los 300 nanómetros de tamaño, han sido hallados en lugares extremos como el permafrost siberiano o bajo el hielo antártico; en comparación, el rinovirus del resfriado común mide apenas unos 30 nanómetros. Arriba, partículas de Tupanvirus.
Adaptación a condiciones extremas
Uno de los aspectos más sorprendentes del hallazgo es su implicación evolutiva. Los virus gigantes suelen infectar protistas que viven en entornos muy variables: desde suelos húmedos hasta aguas termales o permafrost. En estos ambientes, las condiciones de temperatura, nutrientes o estrés celular pueden cambiar de forma drástica.
Las células eucariotas responden a estas situaciones reduciendo la síntesis global de proteínas y activando mecanismos especializados para sobrevivir. Ese apagado general de la traducción suele dificultar la replicación viral.
Sin embargo, Fels y sus colegas han demostrado que los virus gigantes con vIF4F pueden seguir replicándose incluso cuando la célula huésped está sometida a un estrés extremo, como el que causa la falta de nutrientes o el daño celular. Su maquinaria de traducción propia les permite sortear el bloqueo general y mantener la producción de proteínas virales.
En experimentos comparativos, virus relacionados que carecen del complejo vIF4F no mostraron esa capacidad de adaptación. Esto sugiere que la evolución de una maquinaria de traducción propia confiere a los virus gigantes de ADN una ventaja en entornos cambiantes.
¿Cambian estos hallazgos la definición de virus?
El descubrimiento reaviva un debate antiguo: ¿hasta qué punto los virus son entidades vivas? Tradicionalmente se les ha considerado parásitos moleculares dependientes de las células. Pero la presencia de sistemas propios de replicación, transcripción e incluso traducción de proteínas difumina esa frontera.
La capacidad de regular la síntesis de proteínas —un rasgo fundamental de la vida celular— parecía exclusiva de los organismos. Ahora se sabe que algunos virus también la poseen, aunque en forma simplificada y adaptada.
Esto no significa que los virus sean células, pero sí que participan en los mismos procesos básicos. Según Fels, «la evolución de complejos como el vIF4F sugiere que los virus no solo parasitan la maquinaria celular, sino que han contribuido a su diversidad y sofisticación a lo largo del tiempo».
Algunos investigadores incluso plantean la posibilidad de que ciertos mecanismos de regulación de la traducción en eucariotas podrían haberse originado o diversificado gracias a la interacción con virus antiguos.
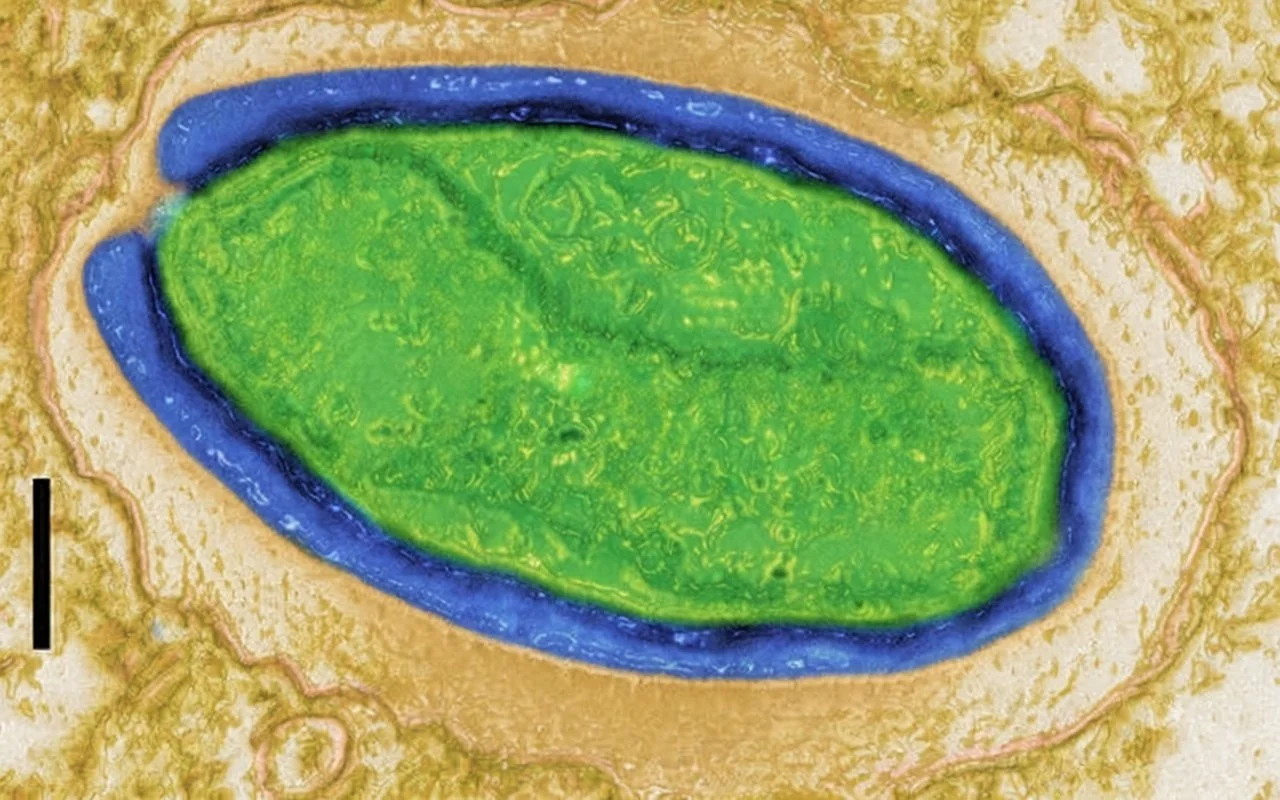
Pandoravirus quercus, observado al microscopio electrónico; la barra de escala equivale a 100 nanómetros. Cortesía: IGS-CNRS/AMU-Coloreada con Grok
Un nuevo modelo para estudiar la traducción
Más allá de su interés evolutivo, el hallazgo abre nuevas vías de investigación. Los virus gigantes ofrecen un sistema más simple que las células para estudiar la regulación de la traducción de proteínas. Su complejo vIF4F es más pequeño y menos complejo que el eIF4F eucariota, pero cumple funciones similares.
Comprender cómo este sistema minimalista logra controlar la síntesis proteica podría ayudar a desentrañar los principios fundamentales de la traducción. También podría inspirar nuevas herramientas biotecnológicas o estrategias antivirales.
Además, el estudio refuerza la idea de que los virus son grandes innovadores moleculares. A lo largo de la evolución, han incorporado y modificado genes celulares, generando nuevas funciones. En el caso de los virus gigantes de ADN, ese proceso ha dado lugar a una maquinaria de traducción propia.
Implicaciones científicas y evolutivas
La imagen tradicional de los virus como entidades simples y dependientes está quedando obsoleta. Cada nuevo hallazgo sobre los virus gigantes revela una complejidad inesperada: genes relacionados con el metabolismo, la reparación del ADN o la fotosíntesis, y ahora un sistema propio para iniciar la síntesis de proteínas.
Este estudio muestra que la frontera entre lo vivo y lo no vivo es más porosa de lo que se pensaba. Los virus no son meros pasajeros de la evolución biológica; son actores activos que han contribuido a moldear los procesos fundamentales de la vida.
En un momento en que la biología busca comprender sus orígenes y su diversidad, los virus gigantes se perfilan como piezas clave. No solo desafían nuestras definiciones, sino que también ofrecen una ventana a la historia profunda de los mecanismos celulares.
Quizá la pregunta ya no sea si los virus están vivos, sino hasta qué punto la vida tal como la conocemos es inseparable de ellos.▪️(19-febrero-2026)
Fuente: Fels, J. Maximilian et al. Giant DNA viruses encode a hallmark translation initiation complex of eukaryotic life. Cell (2026). DOI: 10.1016/j.cell.2026.01.008