Restaurar el orden celular podría frenar la metástasis del cáncer de mama más agresivo
Investigadores en Nueva York hallan una forma inesperada de frenar la expansión del cáncer de mama más agresivo: restaurar el orden en las células antes de que se diseminen.
Por Enrique Coperías
El cáncer de mama triple negativo es un subtipo de tumor mamario especialmente agresivo que representa alrededor del 10 al 15% de los casos diagnosticados. En los casos de metástasis, solo el 11% de las mujeres con cáncer de mama triple negativo metastásico sobreviven a los cinco años del diagnóstico. Foto: Yap
El cáncer de mama triple negativo es una de las formas más agresivas y difíciles de tratar de este tumor. Sin embargo, un estudio del Weill Cornell Medicine, en Nueva York, apunta a una vía inesperada para impedir su diseminación: devolver el orden a las células cuando se dividen.
El trabajo, publicado en la revista Cancer Discovery, muestra que una enzima llamada EZH2 induce divisiones celulares caóticas que permiten a las células tumorales migrar a otros órganos, y que los fármacos que bloquean esta enzima podrían frenar la metástasis del cáncer de mama.
«La metástasis es la principal razón por la que las pacientes con cáncer de mama triple negativo tienen tan mal pronóstico —explica el doctor Vivek Mittal, investigador principal y profesor de Cirugía Cardiotorácica en el Weill Cornell Medicine. Y añade—: Nuestro estudio sugiere una nueva estrategia terapéutica: bloquear la metástasis antes de que empiece, ayudando así a las pacientes a superar este cáncer tan letal».
Qué es el cáncer de mama triple negativo
El cáncer de mama triple negativo es un subtipo de tumor mamario especialmente agresivo que representa alrededor del 10% al 15% de los casos diagnosticados. Su nombre proviene de la ausencia de tres receptores que suelen guiar los tratamientos convencionales: los de estrógeno, progesterona y HER2.
Al no contar con estas dianas terapéuticas, este tipo de cáncer no responde a las terapias hormonales ni a los fármacos dirigidos más comunes, lo que deja como principales opciones la quimioterapia y, en algunos casos, la inmunoterapia.
Además, tiene una mayor probabilidad de metastatizar —extenderse a otros órganos— y de reaparecer tras el tratamiento, lo que lo convierte en uno de los desafíos más complejos de la oncología actual. El mal pronóstico es de tal gravedad que solo el 11% de las mujeres con cáncer de mama triple negativo metastásico sobreviven a los cinco años del diagnóstico.
Una visión opuesta al dogma oncológico
El hallazgo desafía una idea extendida en la investigación oncológica: que incrementar los errores en la división celular podría llevar a las células tumorales a un punto de colapso y provocar su muerte. El nuevo estudio plantea justo lo contrario.
Cuando una célula normal se divide, su material genético —los cromosomas— se duplica y se reparte equitativamente entre las dos células hijas. En muchos tumores, este proceso se descontrola y genera inestabilidad cromosómica: las células terminan con demasiados o muy pocos cromosomas, o con combinaciones anómalas.
«Intentar empujar a las células cancerosas aún más hacia el caos puede ser peligroso —advierte Mittal en un comunicado del Weill Cornell Medicine. Y continúa—… Si no se alcanza el punto de ruptura exacto, se corre el riesgo de crear una enfermedad más agresiva. Nuestros resultados indican que restaurar el orden en la división celular, en lugar de empeorar el desorden, puede detener la diseminación del cáncer».
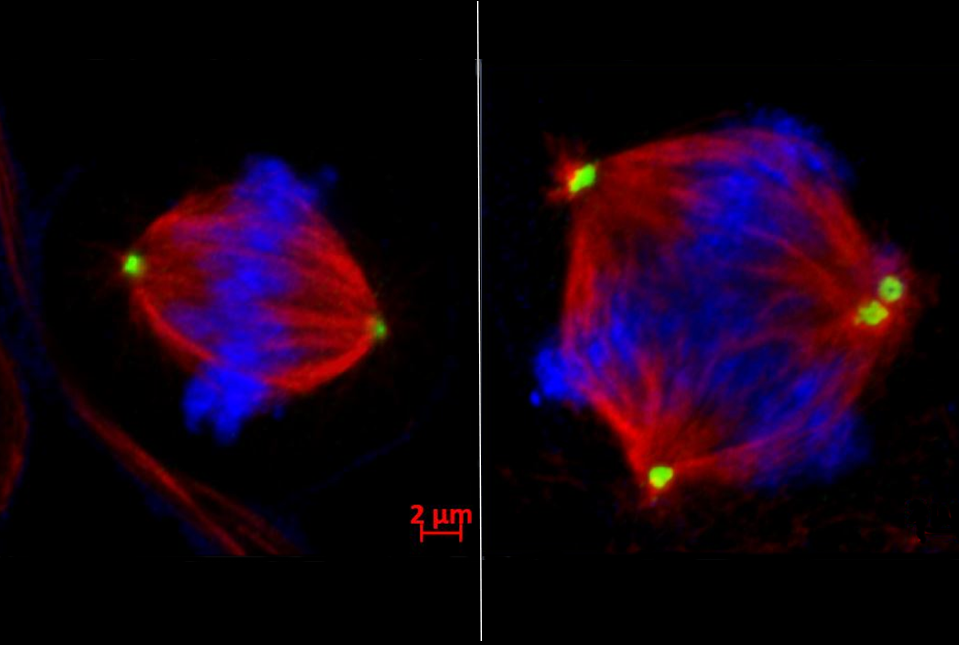
Izquierda: división celular normal, con los cromosomas (en azul) alineados y listos para ser separados en dos células hijas por los dos centrosomas (en verde). Derecha: en una división defectuosa, el exceso de centrosomas provoca la formación de múltiples células con inestabilidad cromosómica. Cortesía: Dra. Shelley Yang Bai / Weill Cornell Medicine.
EZH2: la enzima que desata el caos en la división celular
El estudio, codirigido por la doctora Shelley Yang Bai, ahora investigadora posdoctoral en el mismo laboratorio, y por el oncólogo Samuel Bakhoum (entonces en el Memorial Sloan Kettering Cancer Center), identifica a la enzima histona-lisina metiltransferasa (EZH2) como el eslabón perdido entre los cambios epigenéticos —modificaciones químicas que alteran la actividad del ADN sin cambiar su secuencia— y la capacidad de las células cancerosas para metastatizar.
Recordemos que, en condiciones normales, la EZH2 forma parte del complejo proteico PRC2, cuya tarea es modificar químicamente las histonas, las proteínas alrededor de las cuales se enrolla el ADN. Esta modificación compacta la cromatina —la estructura que organiza el ADN en el núcleo—, impidiendo que la maquinaria celular acceda a determinados genes y, por tanto, silenciando su expresión.
Este mecanismo es esencial durante el desarrollo embrionario, la diferenciación celular y la regeneración de tejidos, ya que permite mantener la identidad de cada tipo de célula.
Inhibir la enzima con tazemetostat
Pues bien, en los tumores de mama triple negativo, aproximadamente un 5% de las células presentan características que las hacen especialmente propensas a invadir otros órganos: un metabolismo distinto, una fuerte inestabilidad cromosómica y alteraciones epigenéticas.
El equipo de Mittal descubrió que en estas células la enzima EZH2 está sobreproducida, lo que provoca el silenciamiento de genes esenciales para que los cromosomas se repartan correctamente durante la división celular.
El análisis de datos de pacientes confirmó la relación: aquellas con niveles más altos de EZH2 mostraban también más alteraciones cromosómicas en sus tumores. En modelos celulares, inhibir la enzima con tazemetostat, un fármaco aprobado por la Administración de Alimentos y Medicamentos de Estados. Unidos (FDA) para otros tipos de cáncer, redujo notablemente esos errores; al contrario, aumentar artificialmente la cantidad de EZH2 los multiplicó.
Del caos cromosómico a la metástasis
Los experimentos con ratones confirmaron la conexión directa entre la enzima EZH2, el caos cromosómico y la diseminación tumoral. Los animales con tumores que sobreexpresaban la enzima desarrollaron muchas más metástasis pulmonares que aquellos con niveles normales.
El mecanismo molecular resultó ser sorprendente. La EZH2 silencia el gen tankirasa 1, encargado de coordinar la maquinaria que separa los cromosomas. Su inactivación genera una acumulación excesiva de otra proteína, la CPAP, lo que multiplica los centrosomas, estructuras que tiran de los cromosomas durante la división. El resultado: divisiones defectuosas en tres o más células hijas y un desorden genético explosivo.
«Por primera vez hemos conectado a la EZH2, un regulador epigenético, con la inestabilidad cromosómica de manera directa», subraya Bai.
Cuando los investigadores bloquearon la acción de la enzima EZH2, los centrosomas volvieron a su número normal y las metástasis disminuyeron de forma significativa en los modelos preclínicos.
Nuevas terapias contra la metástasis: hacia la medicina de precisión
Los inhibidores de la enzima EZH2 podrían convertirse en las primeras terapias capaces de controlar directamente la inestabilidad cromosómica, uno de los motores de la metástasis.
«Este trabajo ofrece un enfoque muy prometedor para tratar el cáncer de mama triple negativo atacando la raíz del problema —afirma la doctora Magdalena Plasilova, cirujana oncológica en el NewYork-Presbyterian/Weill Cornell Medical Center y coautora del estudio. Y añade—: Veo a diario el impacto devastador de las metástasis en mis pacientes, y estos resultados abren una ventana de esperanza para mejorar su supervivencia».
El equipo de Mittal planea ahora ensayos clínicos para probar la seguridad y eficacia de estos fármacos en pacientes con alto riesgo de metástasis.
«Nuestra investigación abre la puerta a usar inhibidores de la EZH2 no solo en cáncer de mama, sino también en otros tumores con inestabilidad cromosómica, como el adenocarcinoma de pulmón», señala el investigador.
Restaurar el orden, y no sembrar más caos, podría ser la clave para frenar la expansión del cáncer de mama más agresivo.▪️
Información facilitada por el Centro Médico Weill Cornell
Fuente: Vivek Mittal et al. Epigenetic regulation of chromosomal instability by EZH2 methyltransferase. Cancer Discovery (2025). DOI: https://doi.org/10.1158/2159-8290.CD-25-0947