Una dieta rica en grasas empuja al hígado hacia el cáncer, según la ciencia
Una investigación publicada en la prestigiosa revista Cell advierte de que las dietas ricas en grasas no solo dañan el hígado, sino que reprograman sus células hacia un estado inmaduro que las hace más vulnerables a transformarse en cancerosas mucho antes de que aparezcan los primeros síntomas.
Por Enrique Coperías
Una nueva investigación del MIT muestra cómo una dieta rica en grasas reprograma las células del hígado y las vuelve más susceptibles a transformarse en cancerosas. Cortesía: Christine Daniloff / MIT
La relación entre una dieta rica en grasas y el cáncer de hígado se ha explicado tradicionalmente como una consecuencia indirecta del sobrepeso, la inflamación crónica y la cirrosis.
Pero una nueva investigación internacional añade ahora una pieza clave al puzle y sugiere que el problema empieza mucho antes, dentro de las propias células hepáticas. El exceso sostenido de grasas no solo daña a esta glándula, sino que empuja a sus células a un estado inmaduro y primitivo que las vuelve especialmente vulnerables a transformarse en cancerosas.
El trabajo, publicado en la revista Cell, ofrece una mirada inédita y a largo plazo sobre cómo el hígado se adapta —o se adapta mal— a una dieta hipercalórica rica en grasas. A partir de experimentos en ratones, análisis de tejidos humanos y técnicas avanzadas de biología celular, los investigadores muestran que las células hepáticas sometidas a estrés metabólico continuo activan programas de supervivencia celular y regeneración, que, paradójicamente, si se mantienen en el tiempo, siembran el terreno para el cáncer.
🗣️«Si las células se ven obligadas a enfrentarse una y otra vez a un factor de estrés, como una dieta rica en grasas, acabarán haciendo cosas que les ayuden a sobrevivir, pero a costa de aumentar su susceptibilidad a desarrollar tumores», explica Alex K. Shalek, uno de los autores principales del estudio, en un comunicado del MIT.
Qué ocurre dentro de las células hepáticas bajo estrés metabólico
El hígado es uno de los órganos más versátiles del cuerpo humano. Regula el metabolismo, produce proteínas esenciales, detoxifica sustancias peligrosas y tiene una notable capacidad de regeneración. Puede recuperar su tamaño y función incluso después de perder dos tercios de su masa.
Pero esa fortaleza tiene un reverso. Cuando el daño no es puntual, sino constante —como ocurre con una dieta rica en grasas durante años—, las mismas herramientas que permiten sobrevivir pueden acabar volviéndose contra el organismo.
El estudio se centra en una enfermedad cada vez más común: la enfermedad hepática grasa asociada con disfunción metabólica, antes conocida como hígado graso no alcohólico. Afecta ya a más de un tercio de la población mundial y está estrechamente ligada a la obesidad y a los hábitos alimentarios occidentales. En su forma más grave, puede evolucionar hacia inflamación, fibrosis, cirrosis y, finalmente, carcinoma hepatocelular, uno de los cánceres más letales.
De hepatocitos maduros a células inmaduras y vulnerables
Lo sorprendente es que el riesgo de cáncer no parece depender únicamente de la acumulación de mutaciones genéticas, como se pensaba. Los autores de este trabajo demuestran que, incluso antes de que aparezcan alteraciones genéticas relevantes, las células hepáticas ya han cambiado de manera profunda su identidad celular.
Bajo el bombardeo constante de grasas, estas células dejan de comportarse como hepatocitos maduros y especializados y empiezan a activar programas propios del desarrollo embrionario y de la regeneración tisular.
👉 En términos sencillos: las células olvidan quiénes son.
Este proceso de desdiferenciación celular no las convierte automáticamente en cancerosas, pero sí las coloca en un estado de vulnerabilidad. Son células más plásticas, más proclives a dividirse y menos comprometidas con sus funciones normales.
En ese contexto, cualquier mutación posterior tiene muchas más probabilidades de desencadenar un tumor.
«Esto se parece mucho a un intercambio: se prioriza lo que es bueno para que la célula individual se mantenga viva en un entorno estresante, a expensas de lo que el tejido hepático en su conjunto debería estar haciendo», resume Constantine Tzouanas, primer autor del estudio, en la nota de prensa del MIT.
El papel de la epigenética y la memoria celular
Para llegar a esta conclusión, los investigadores alimentaron a ratones con una dieta rica en grasas durante distintos periodos de tiempo, desde meses hasta más de un año. A lo largo del tiempo, analizaron millones de células individuales utilizando técnicas de secuenciación de ARN y epigenética, capaces de reconstruir la historia molecular de cada célula. El resultado fue un mapa detallado de cómo el hígado cambia gradualmente bajo estrés metabólico crónico.
Lo que observaron fue un patrón claro y progresivo. A medida que avanzaba la exposición a la dieta grasa, las células activaban genes relacionados con la supervivencia celular, la reparación del daño y la proliferación celular. Al mismo tiempo, apagaban genes clave responsables de funciones básicas del hígado, como el metabolismo de nutrientes, la producción de proteínas plasmáticas y la regulación inmunitaria.
Este desequilibrio no era transitorio. Persistía en el tiempo y se acentuaba en los animales que acababan desarrollando tumores hepáticos de forma espontánea. De hecho, las mismas señales moleculares detectadas en las células no tumorales sometidas a estrés aparecían amplificadas en los tumores ya formados, lo que sugiere una continuidad entre ambos estados.
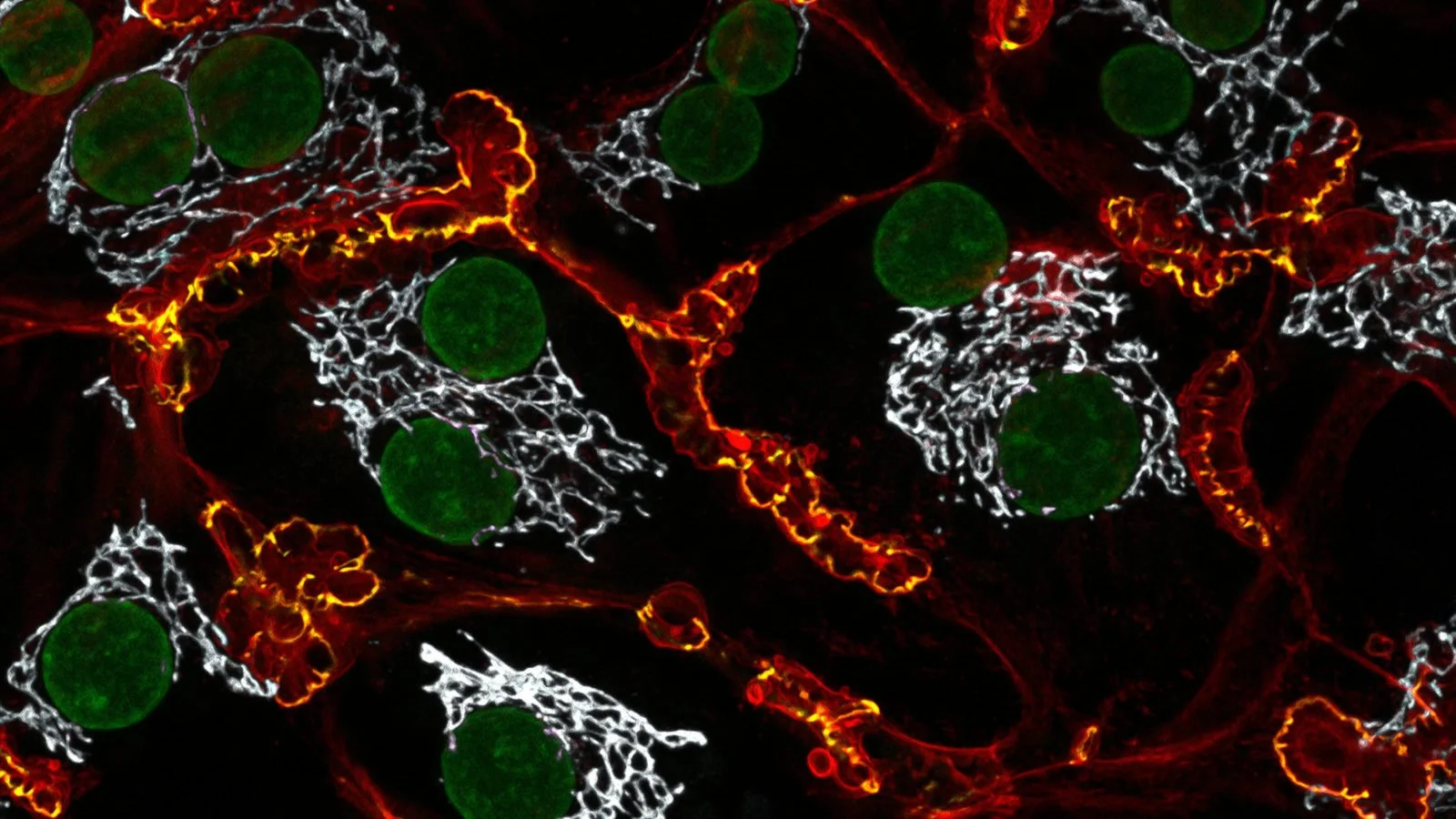
Células hepáticas. Bajo el bombardeo constante de grasas, estas células dejan de comportarse como hepatocitos maduros y especializados y empiezan a activar programas propios del desarrollo embrionario y de la regeneración tisular. Cortesía: Dr. Francisco Lázaro-Diéguez / Albert Einstein College of Medicine / https://www.nikonsmallworld.com/
Por qué el daño empieza antes de que aparezca el cáncer
Uno de los hallazgos más relevantes del estudio es la identificación de cambios epigenéticos tempranos —modificaciones químicas que regulan la expresión génica sin alterar el ADN— que preceden a la aparición del cáncer de hígado. Estas marcas epigenéticas crean una especie de memoria del estrés metabólico, dejando a las células preparadas para responder de forma exagerada a futuras agresiones.
🗣️ «Estas células ya han activado los mismos genes que van a necesitar para volverse cancerosas. Ya se han alejado de la identidad madura que, de otro modo, frenaría su capacidad de prolifera», señala Tzouanas.
Ese reequilibrio, útil a corto plazo, se convierte en un problema cuando el estímulo dañino no cesa.
Una mutación equivocada, y todo se acelera hacia el precipicio
El estudio también identifica nodos moleculares determinantes en este proceso, como la supresión de la producción de cuerpos cetónicos —una vía metabólica protectora— y la activación de rutas relacionadas con el colesterol y la señalización celular asociada al cáncer. En modelos animales, manipular estos mecanismos fue suficiente para acelerar o frenar la aparición de tumores, lo que refuerza la idea de que no se trata de simples correlaciones.
«En cuanto una célula adquiere la mutación equivocada, todo se acelera, porque ya lleva ventaja en algunos de los rasgos característicos del cáncer», añade el investigador.
Para comprobar que estos hallazgos no eran exclusivos de los ratones, los investigadores analizaron datos de pacientes humanos con hígado graso, cirrosis y cáncer hepático. Encontraron los mismos patrones de desdiferenciación celular, activación de programas embrionarios y pérdida de funciones maduras del hepatocito. Además, estas señales se asociaban con peor pronóstico y menor supervivencia en los pacientes con cáncer.
El daño molecular se acumula de forma silenciosa durante año
«Los pacientes que presentaban una mayor expresión de estos genes de supervivencia celular que se activan con las dietas ricas en grasas sobrevivían menos tiempo después de que se desarrollaran los tumores —explica Tzouanas—. Y si un paciente tiene una menor expresión de los genes que sostienen las funciones normales del hígado, también sobrevive menos tiempo».
Uno de los mensajes más inquietantes del trabajo es que estos cambios aparecen en fases tempranas de la enfermedad, cuando todavía no hay cirrosis ni tumores visibles. Es decir, el daño molecular se acumula de forma silenciosa durante años antes de que se manifieste clínicamente.
Esto tiene implicaciones profundas para la prevención del cáncer de hígado. Sugiere que el riesgo no empieza cuando aparecen las cicatrices en el órgano, sino mucho antes, cuando la dieta y el metabolismo empujan a las células a un estado de estrés permanente. También abre la puerta a nuevas estrategias terapéuticas centradas en restaurar la identidad celular del hígado o bloquear los programas de supervivencia mal adaptados antes de que el cáncer se establezca.
Implicaciones para la prevención y la salud pública
Los autores subrayan que no todas las personas con dietas ricas en grasas desarrollarán cáncer hepático, pero el estudio refuerza la idea de que la alimentación tiene efectos directos y duraderos sobre la biología celular, más allá del peso corporal o los niveles de azúcar en sangre. El hígado, en particular, actúa como un sensor metabólico extremadamente sensible a los excesos prolongados.
En un contexto global marcado por el aumento de la obesidad y de las enfermedades metabólicas, estos hallazgos añaden urgencia a las recomendaciones dietéticas. No se trata solo de evitar el sobrepeso, sino de proteger la integridad celular de órganos clave frente a un entorno nutricional para el que no estamos biológicamente preparados.
El mensaje final del estudio es tan cristalino como incómodo: una dieta rica en grasas no solo sobrecarga al hígado, sino que lo empuja a un estado más primitivo y peligroso. Un terreno fértil donde el cáncer de hígado puede echar raíces mucho antes de que seamos conscientes del daño.
«Ahora contamos con toda una serie de nuevas dianas moleculares y con una mejor comprensión de la biología que hay detrás, lo que podría darnos nuevas vías para mejorar los resultados clínicos en los pacientes», concluye Shalek.▪️
Información facilitada por MIT News
Fuente: Tzouanas, Constantine N. et al. Hepatic adaptation to chronic metabolic stress primes tumorigenesis. Cell (2025). DOI: 10.1016/j.cell.2025.11.031