Cómo las células madre aprenden a orientarse en el cerebro tras un ictus
Un estudio internacional demuestra que las neuronas derivadas de células madre trasplantadas tras un ictus conservan códigos genéticos que les permiten orientarse en el cerebro adulto, atravesar tejido cicatricial y reconstruir circuitos dañados. El hallazgo abre nuevas vías para mejorar la terapia celular en las enfermedades neurológicas.
Por Enrique Coperías, periodista científico
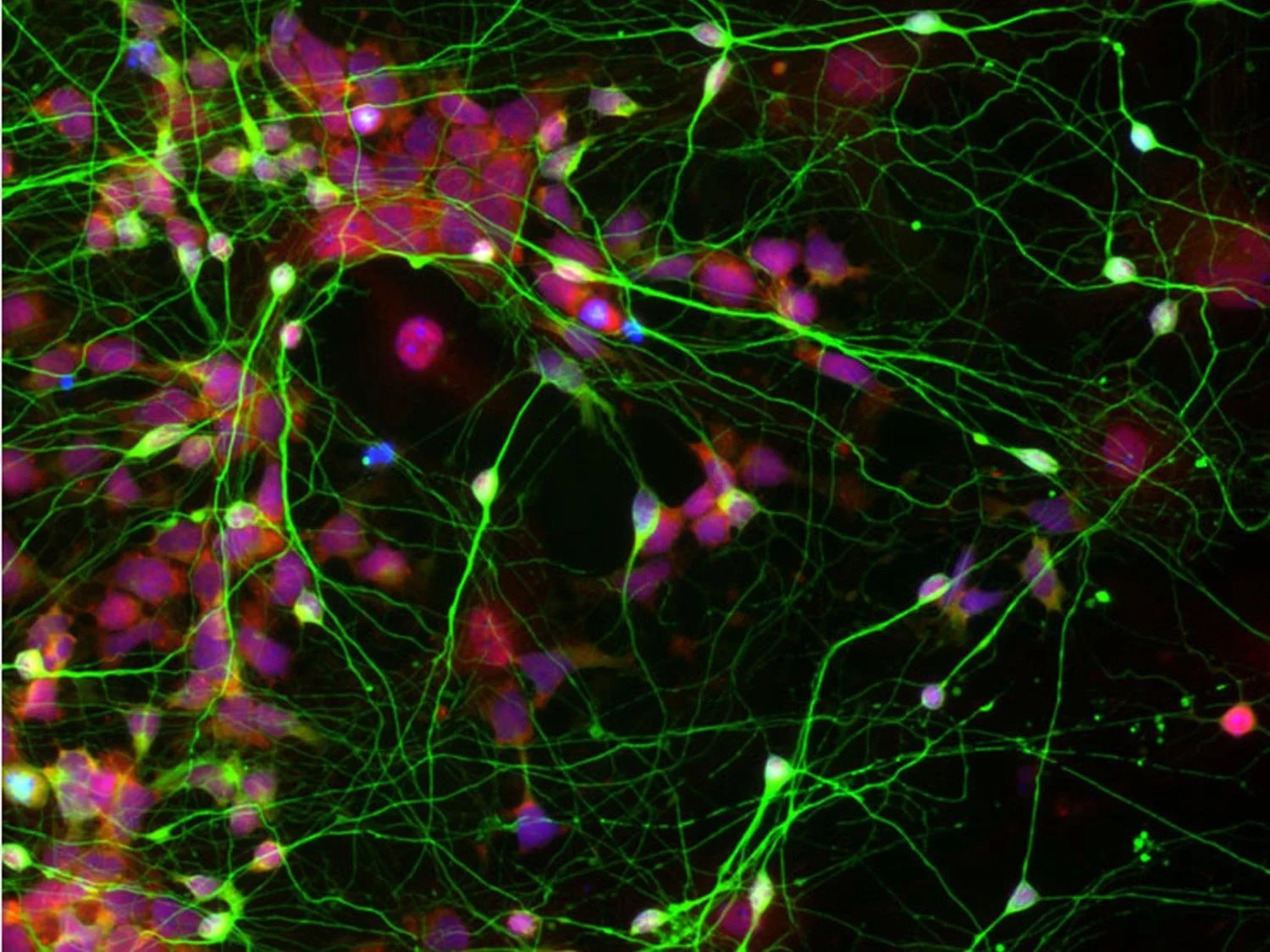
Células madre neurales humanas (en rojo), reprogramadas a partir de células de la piel adulta, se diferencian en neuronas (en verde) capaces de integrarse y establecer conexiones en el cerebro, un proceso clave para la reconstrucción de circuitos dañados tras un ictus. Crédito: Chen Lab / Penn State University
La neurociencia moderna ha aprendido a convivir con una limitación incómoda: el cerebro adulto apenas se regenera. A diferencia de tejidos como la piel o incluso la córnea —capaz de recuperarse de pequeñas lesiones en cuestión de horas—, las neuronas están diseñadas para durar toda una vida.
Cuando un ictus o infarto cerebral destruye parte del tejido cerebral, el daño suele ser permanente. Sin embargo, un nuevo estudio internacional aporta una pista clave sobre cómo la terapia con células madre podría empezar a sortear ese obstáculo y reconstruir circuitos cerebrales rotos.
Investigadores del Sanford Burnham Prebys Medical Discovery Institute y de la Duke-National University of Singapore (NUS) Medical School publican este jueves en la revista Cell Stem Cell los resultados de una terapia experimental basada en células madre humanas que, al ser trasplantadas en ratones con lesiones similares a las provocadas por un ictus, no solo sobreviven, sino que maduran, se integran en los circuitos existentes y contribuyen a restaurar funciones perdidas.
El trabajo va un paso más allá, ya que muestra cómo esas neuronas saben hacia dónde crecer y con qué otras células conectarse.
Células madre en un entorno hostil
El primer gran obstáculo para la regeneración cerebral es el entorno que deja el ictus. «En el cerebro adulto tras un ictus se forma un quiste, una cavidad llena de todo tipo de moléculas inflamatorias, así que es como si las células terapéuticas estuvieran nadando en un pantano peligroso lleno de amenazas —explica Su-Chun Zhang, director del Centro de Enfermedades Neurológicas de Sanford Burnham Prebys.
A ese ambiente hostil se suma una cicatriz que rodea la lesión: «Si eso no fuera suficiente, el tejido cicatricial rodea la cavidad para proteger al cerebro de más daños, pero también forma una barrera contra cualquier intento de regeneración», comenta Zhang.
Ante esta situación, muchas estrategias optan por injertar células madre en zonas próximas, más favorables, con la esperanza de que los circuitos neuronales se reorganicen rodeando la lesión. Zhang no está convencido de ese rodeo.
«Tras un ictus, la lesión dañada suele ser muy grande y supone un desafío inmenso para reconectar funcionalmente el cerebro con el tronco encefálico y la médula espina», señala este investigador. Para Zhang, el daño debe repararse directamente.
Neuronas con mapas internos de navegación
Con ese objetivo, el equipo desarrolló una combinación de fármacos y proteínas estructurales capaz de crear un entorno de apoyo dentro de la cavidad del ictus. El resultado fue que las células trasplantadas sobrevivieron y crecieron hasta rellenar la región dañada.
🗣️ «Una vez que las células trasplantadas pueden sobrevivir y convertirse en neuronas, empezamos a preguntarnos si esas neuronas son capaces de atravesar el tejido cicatricial y hacer nervios funcionales creando nuevas conexiones y reconstruyendo los circuitos interrumpidos», afirma Zhang.
La cuestión clave era conocer si esas conexiones eran las correctas. «¿Estaban reconstruyendo puentes que habían sido demolidos o creando puentes nuevos que no llevan a ninguna parte?», se preguntaban los investigadores. La respuesta fue sorprendente: «Descubrimos que distintos tipos de neuronas trasplantadas encontraban a sus propios socios incluso en el complicado contexto del cerebro adulto —explica Zhang—. Todavía pueden encontrar sus objetivos de una manera muy específica».
Códigos genéticos que guían las conexiones
Mediante reconstrucciones tridimensionales, el equipo observó que las largas proyecciones neuronales con las que las neuronas se comunican reproducían los patrones normales de la vía que conecta la corteza cerebral con la médula espinal. Para entender cómo lograban orientarse, los científicos marcaron genéticamente las células injertadas y analizaron su expresión génica.
«Revelamos que cada tipo celular tiene su propio código genético y, una vez que las células se convierten en neuronas, ese código le dice a cada una dónde enviar sus proyecciones o axones, a distintas partes del cerebro y de la médula espinal», explica Zhang.
Según el neurocientífico, se trata de una observación inédita. «Es la primera vez que se informa de este fenómeno tan llamativo, y resulta significativo porque básicamente nos dice que, si tenemos los tipos adecuados de células trasplantadas, ellas ya saben adónde ir y qué hacer para reparar lo que se ha perdido».
Qué implica este hallazgo para la terapia celular
El análisis con técnicas de aprendizaje automático permitió identificar cuatro subtipos de neuronas derivadas de las células trasplantadas, cada una con una firma genética distinta relacionada con la guía de axones. El equipo comprobó además el papel de factores de transcripción como el Ctip2: al eliminarlo, los patrones de conexión cambiaban de forma notable, con más axones dirigiéndose hacia regiones como el hipocampo y la amígdala.
🗣️ «Al aprender más sobre estos subtipos de neuronas trasplantadas, podremos predecir sus proyecciones y conectividad para seleccionar los tipos celulares adecuados para la reconstrucción de circuitos concretos en pacientes», apunta Zhang.
Aunque los resultados se han obtenido en modelos animales, el trabajo abre una vía prometedora para la medicina regenerativa. «Abre un futuro esperanzador para la terapia celular y para ayudar a los millones de personas que sufren ictus y otras enfermedades neurológicas devastadoras», concluye el investigador.
El estudio, con primeros autores de la Duke-NUS Medical School, ha contado con financiación pública de Singapur y deja una idea clara: quizá el cerebro adulto no esté tan perdido para la regeneración neuronal como se creía, si se le proporcionan las células —y los códigos— adecuados.▪️
Información facilitada por el Sanford Burnham Prebys
Fuente: Wang, Zhifu et al. Transcriptional code for circuit integration in the injured brain by transplanted human neurons. Cell Stem Cell (2026). DOI: 10.1016/j.stem.2025.12.00