El poder oculto del mundo invisible: la estructura 3D más precisa de un bacteriófago abre una vía terapéutica contra las superbacterias
Un equipo internacional de biólogos ha logrado descifrar con resolución casi atómica la arquitectura de un virus capaz de cazar y destruir bacterias peligrosas. El hallazgo desvela un engranaje molecular de precisión quirúrgica que podría convertirse en una alternativa real a los antibióticos frente a las bacterias superresistentes.
Por Enrique Coperías
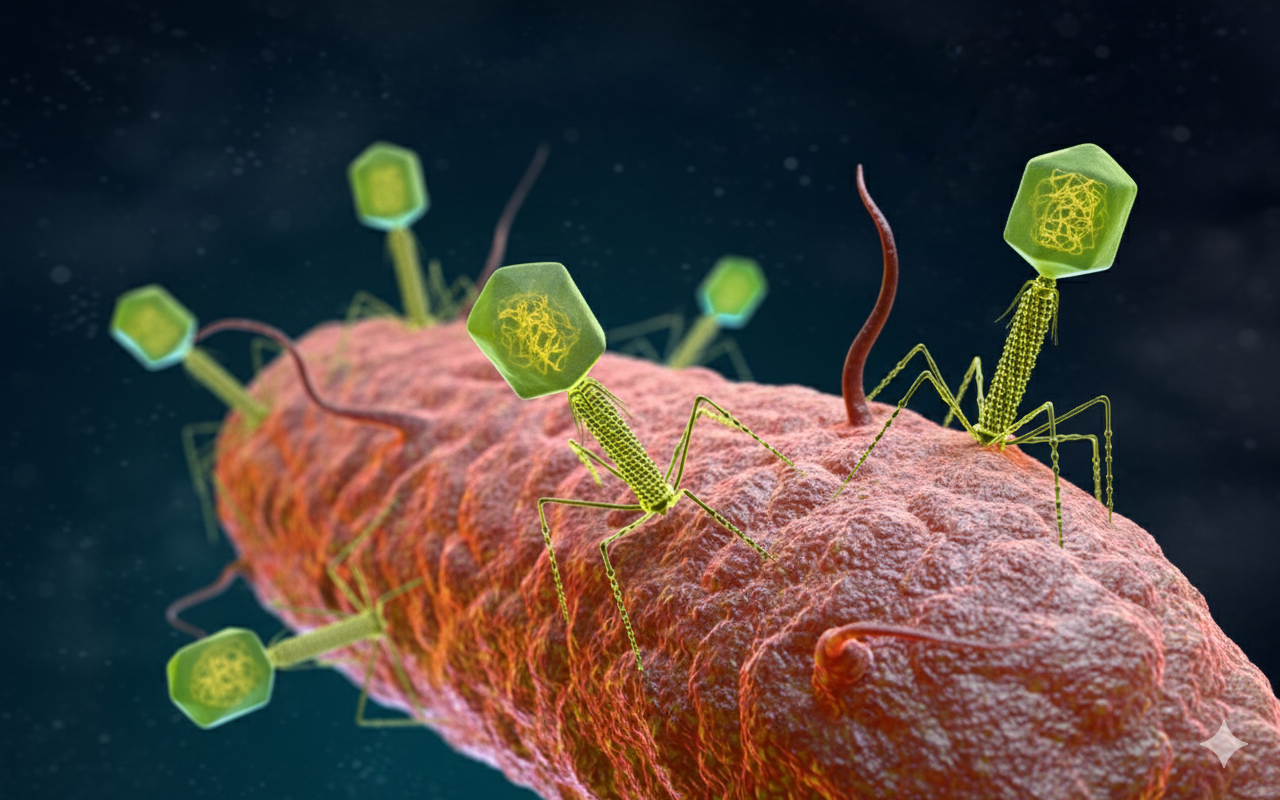
Unas manada de bacteriófagos infectan una bacteria con su material genético. Científicos de la Universidad de Otago han obtenido la estructura 3D ultradetallada del bacteriófago Bas6, un virus capaz de infectar E. coli y considerado una herramienta prometedora en la fagoterapia frente a la creciente resistencia a los antibióticos. Imagen generada con Gemini
En los laboratorios de la Universidad de Otago, en Nueva Zelanda, un equipo de investigadores ha cartografiado con una precisión inédita una de las criaturas más diminutas y fascinantes del planeta: un bacteriófago, un virus especializado en infectar bacterias. Se le conoce como Bas63 y es un miembro del género Felixounavirus.
La susodicha criatura difícilmente aparecerá en titulares de prensa ni abriendo los informativos de la televisión, pero su retrato estructural, reconstruido con un nivel de detalle que roza lo atómico, podría resultar clave en la lucha contra uno de los mayores desafíos sanitarios de nuestro tiempo: las bacterias resistentes a los antibióticos.
La urgencia de desarrollar alternativas a los antibióticos queda aún más clara a la luz del nuevo informe presentado por la Organización Mundial de la Salud (OMS): en 2023, una de cada seis infecciones bacterianas confirmadas en laboratorio que terminaron convirtiéndose en cuadros clínicos habituales resultó ser resistente a los tratamientos disponibles. El mismo análisis revela que, entre 2018 y 2023, la resistencia aumentó más de un 40 % en las combinaciones patógeno-antibiótico monitorizadas, con un incremento anual medio de entre el 5 % y el 15 %, una tendencia que amenaza con desbordar la capacidad de la medicina actual para contener las infecciones más comunes.
Por qué este bacteriófago importa en la era posantibióticos
El estudio, realizado junto con la comunidad maorí Ōtākou Whakaihu Waka y publicado en la revista Science Advances, demuestra hasta qué punto la belleza y la ingeniería del mundo microscópico siguen asombrando incluso a los científicos más curtidos. Bas63 se revela como un prodigio de biología modular: una cabeza icosaédrica casi perfecta, una cola capaz de contraerse como un resorte molecular y un arsenal de fibras que le permiten detectar, aferrarse y perforar células bacterianas con la precisión de una taladradora en miniatura.
En palabras del autor principal del estudio, James Hodgkinson-Bean, los bacteriófagos son «extremadamente emocionantes en el mundo científico, ya que los investigadores buscan alternativas a los antibióticos para combatir el creciente riesgo de la resistencia antimicrobiana». Y añade que «los virus bacteriófagos no son dañinos para ninguna forma de vida multicelular, y pueden dirigirse y matar de manera muy selectiva a una bacteria específica. Por ello, están siendo cada vez más investigados y aplicados en la fagoterapia para tratar bacterias altamente resistentes a los medicamentos».
Pero más allá de la estética, el trabajo ofrece un mapa estructural que servirá de referencia para comprender mejor a los bacteriófagos del género Felixounavirus, famosos por su eficacia contra bacterias como la Salmonella y la Escherichia coli. La primera es uno de los agentes patógenos alimentarios más extendidos del mundo y causa millones de casos de gastroenteritis cada año. Se transmite sobre todo a través de alimentos contaminados —huevos, carne, aves, productos frescos— y puede provocar desde diarreas leves hasta infecciones invasivas graves, especialmente en niños, ancianos y personas inmunodeprimidas.
Por su parte, la E. coli, aunque es una bacteria habitual y necesaria en el intestino humano, incluye variantes patógenas capaces de provocar diarreas graves, infecciones urinarias, septicemias e incluso fallos renales, como el síndrome urémico hemolítico.
No cabe duda de que, en una era amenazada por las superbacterias, estudios como este ayudan a sentar las bases para el diseño racional de terapias basadas en fagos: virus que podrían sustituir o complementar a los antibióticos.
El mapa estructural más completo de un fago «Felixounavirus»
La proeza técnica que permite este nivel de detalle es la criomicrospopía electrónica (cryo-EM), una tecnología que ha transformado la biología estructural en la última década. Congelando las partículas virales a temperaturas extremas y fotografiándolas con haces de electrones, los investigadores pueden reconstruir modelos tridimensionales de sus componentes con resoluciones que rondan los 3 angströms, el tamaño de un pequeño átomo.
A partir de decenas de miles de imágenes, el equipo obtuvo reconstrucciones de cada una de las partes del virus: desde la cápside, o sea, la cubierta proteica que protege su ADN a alta presión, hasta la compleja plataforma que utiliza para adherirse a su víctima.
El resultado es un plano tridimensional de al menos veintitrés proteínas diferentes, ensambladas con la precisión de un reloj suizo.
La cápside: un blindaje molecular decorado y evolutivamente sofisticado
En la cúspide del virus se encuentra la cápside, un poliedro formado por 535 copias de una proteína principal y decorado por dos tipos de proteínas accesorias. Estas decoraciones, llamadas β-tulip y Hex-Dec, forman patrones repetitivos que le otorgan estabilidad y quizá otras funciones aún desconocidas, como ayudar al virus a interactuar con superficies bacterianas o sobrevivir mejor en ambientes hostiles.
Una de estas dos proteínas, la Hex-Dec, es especialmente llamativa: se dispone únicamente en ciertos puntos de la cápside y presenta una estructura modular con dominios semejantes a inmunoglobulinas. Este tipo de dominios aparece en proteínas que suelen participar en interacciones con otras macromoléculas, por lo que los autores no descartan que su presencia influya en el modo en que el fago se orienta o se fija a su entorno.
Lo más sorprendente de todo es la variabilidad que presentan estas proteínas accesorias entre especies cercanas del mismo género. Si los fagos son expertos en adaptarse a sus huéspedes, las decoraciones parecen ser un terreno fértil para la innovación evolutiva.
Estructura molecular del bacteriófago Bas63, un virus que infecta E. coli, reconstruida con máxima resolución. Crédito: University of Otago.
Los bigotes y el collar: sensores y bisagra entre cabeza y cola
Entre la cápside y la cola se encuentra el conector, un complejo de proteínas que actúa como bisagra y conducto. El de Bas63 es extraordinariamente elaborado: incluye un collar con doce bigotes o whiskers, unas fibras cortas que emergen en alternancia hacia arriba y hacia abajo.
Estas estructuras no son simples adornos. En otros fagos se ha demostrado que cumplen funciones críticas: los bigotes ayudan a estabilizar el ensamblaje entre la cabeza y la cola, permiten al virus anclarse temporalmente a las paredes bacterianas o actúan como sensores que reconocen señales químicas en la superficie celular.
Los whiskers de Bas63, según el análisis comparativo, son primos cercanos de los que se observan en un virus muy distinto, el podófago GP4, lo que sugiere una sorprendente conservación evolutiva de estos módulos.
El collar está además unido por puentes de disulfuro, una especie de soldaduras químicas que le confieren rigidez adicional. La estrategia tiene sentido: la unión cabeza-cola es un punto crítico en el ciclo vital del fago y cualquier inestabilidad podría poner en riesgo su capacidad infectiva.
La cola contractil: una jeringa molecular de alta precisión
La cola del bacteriófago Bas63 es una obra maestra de bioingeniería natural. Se trata de un tubo rodeado por una vaina helicoidal de proteínas que pueden contraerse violentamente, como un muelle comprimido, para clavar una aguja en la membrana de la bacteria y permitir la inyección a través de ella del ADN viral.
La comparación con T4 —el mítico bacteriófago descrito desde los años 40— es inevitable. Pero Bas63 añade variaciones que podrían ser cruciales para su especialización: dominios proteicos adicionales, adaptadores distintos y una transición peculiar en el número de copias de la proteína cinta métrica (TMP), responsable de definir la longitud de la cola.
En la base de la cola se encuentra un complejo llamado placa basal, un auténtico centro logístico desde el que parten dos tipos de fibras: las fibras cortas, que actúan como sensores iniciales, y las fibras largas, responsables de un anclaje definitivo.
Aunque estas fibras son flexibles y difíciles de visualizar, los autores lograron obtener la suficiente resolución para trazar sus arquitecturas modulares: repeticiones de hélices alfa, dominios en forma de barril β y motivos de histidinas que probablemente coordinan metales para mantener la rigidez.
🗣️ En palabras de Hodgkinson-Bean, «este tipo de investigación es importante para entender cómo podemos seleccionar los bacteriófagos óptimos para terapias, y para comprender las diferencias en el comportamiento infeccioso que observamos en el laboratorio».
Un mosaico evolutivo que se refleja en su arquitectura
Una de las conclusiones más reveladoras del estudio es que, pese a su notable conservación estructural, los virus del género Felixounavirus muestran altas tasas de variación justamente en las partes que utilizan para reconocer a sus huéspedes.
Las fibras largas y cortas son los elementos más diversos: su región final, la que toca la superficie bacteriana, es una auténtica zona caliente de evolución rápida.
También las proteínas Hex-Dec, con su número variable de dominios tipo inmunoglobulina, parecen ser un lienzo en el que la evolución experimenta libremente.
Por el contrario, la cápside y el motor inyector son tan esenciales que apenas toleran variaciones.
Aplicaciones reales: medicina, agricultura, industria
Lo que ofrece este estudio es mucho más que una fotografía detallada de un fago concreto. Representa un atlas estructural para todo un linaje viral con alto potencial terapéutico.
Los Felixounavirus han sido estudiados desde los años 40 por su capacidad para atacar con eficacia cepas patógenas de Salmonella, uno de los patógenos alimentarios más extendidos. Pero para manipularlos de manera segura y eficiente es imprescindible saber cómo están construidos pieza por pieza. La estructura de Bas63 proporciona justamente ese manual de instrucciones.
🗣️«Nuestro plano detallado de un bacteriófago impulsa el diseño racional de aplicaciones médicas, agrícolas e industriales, desde el tratamiento de infecciones hasta la batalla contra la formación de biopelículas en el procesamiento de alimentos y en los sistemas de agua —dice el investigador Mihnea Bostina, autor senior del trabajo. Y añade—: Más allá de la ciencia, los datos 3D, que muestran las raras conexiones de bigotes y collar del virus, las proteínas decorativas de hexámeros y sus diversas fibras caudales, podrían servir de inspiración para artistas, animadores y educadores».
Anatomía de un bacteriófago, con su cabeza, cuello y cola. Cortesía: CSIC
Fagos como fósiles vivientes: una ventana al origen del mundo viral
En un momento en que los virus suelen aparecer en titulares por razones sombrías, trabajos como este recuerdan que también son arquitectos invisibles de nuestro mundo. Comprender su biología no es solo útil para combatir infecciones; es una ventana a la creatividad desbordante de la naturaleza.
Hodgkinson-Bean lo expresa con una imagen poderosa: «Mientras que el ADN suele ser el mejor marcador evolutivo en humanos, la estructura tridimensional de un virus es más informativa sobre sus relaciones evolutivas distantes con otros virus». Y añade una reflexión que atraviesa toda la investigación: «sabemos que los bacteriófagos están emparentados con los virus del herpes… cuando observamos la estructura de un bacteriófago, estamos viendo fósiles vivientes, seres primordiales y antiguo».
Y quizá, si sabemos leer bien estos planos moleculares, también son aliados fundamentales para un futuro en el que los antibióticos ya no basten. ▪️
Información facilitada por la Universidad de Otago
Fuente: James Hodgkinson-Bean et al. Cryo-EM structure of bacteriophage Bas63 reveals structural conservation and diversity in the
Felixounavirus genus. Science Advances (2025). DOI: 10.1126/sciadv.adx0790