Los científicos descubren por qué algunas neuronas resisten a la enfermedad de Alzheimer
Un estudio llevado a cabo en neuronas humanas ha logrado identificar un sistema celular que las protege frente a la proteína tau tóxica, pieza clave en el desarrollo del alzhéimer y otras enfermedades neurodegenerativas, y abre nuevas vías para futuros tratamientos.
Por Enrique Coperías, periodista científico
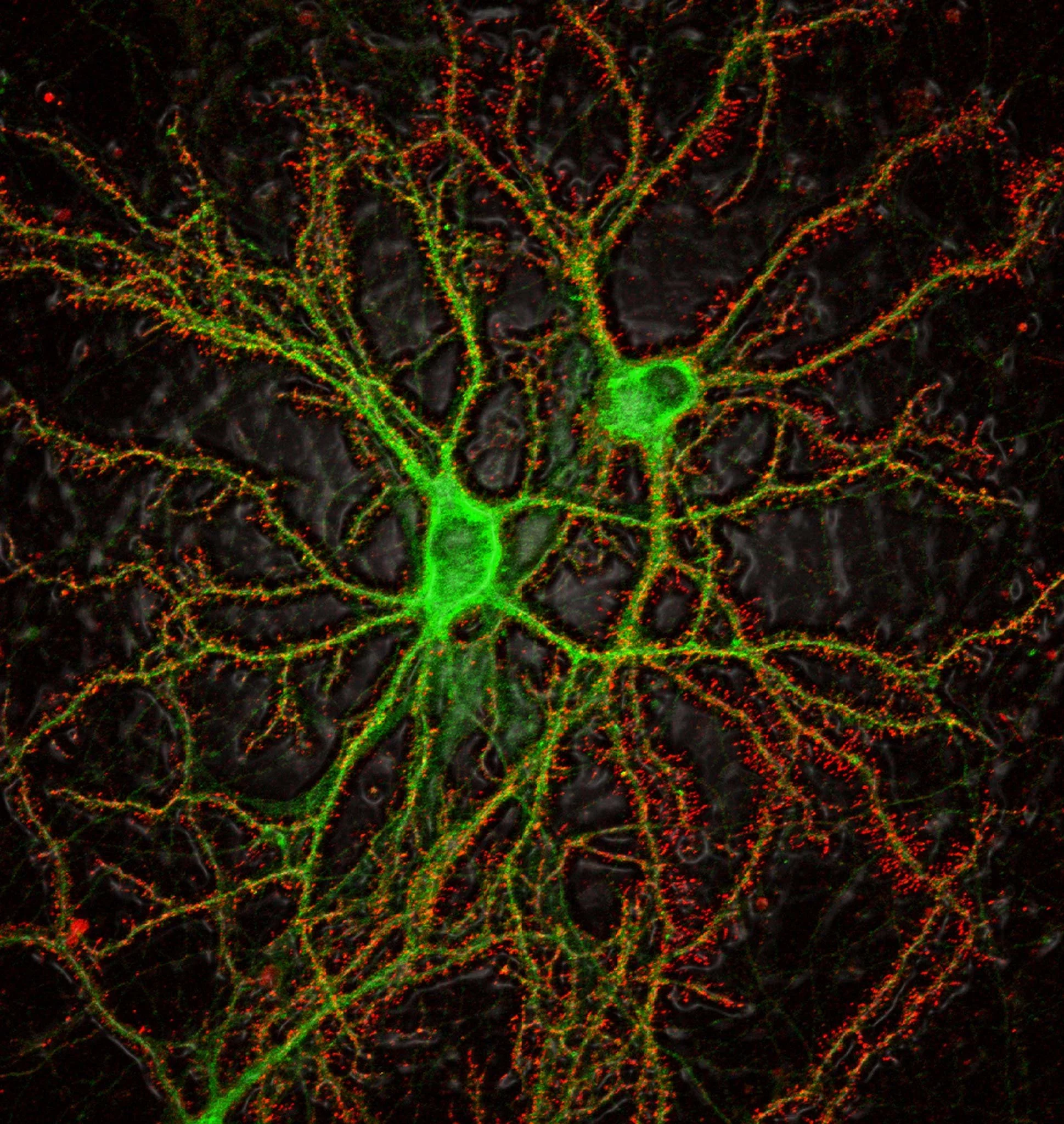
Neuronas del hipocampo atacadas por las neurotoxinas del alzhéimer. Cortesía: Dr. Pascale Lacor / Northwestern University / https://www.nikonsmallworld.com/
El papel de la proteína tau en la neurodegeneración
Los neurólogos describen la enfermedad de Alzheimer como una marea imparable que va anegando el cerebro. Sin embargo, incluso en los cerebros más afectados, hay neuronas que resisten al desaguisado provocado por esta dolencia neurodegenerativa que afecta a más de 55 millones de personas en todo el mundo y será la tercera causa de muerte en el mundo en 2040.
Hablamos de supercélulas que, rodeadas de destrucción, consiguen mantenerse funcionales durante más años que las demás. Entender por qué unas mueren y otras sobreviven es una de las grandes preguntas de la neurociencia moderna.
Ahora, un estudio internacional acaba de aportar una respuesta concreta y esperanzadora: algunas neuronas activan un sistema interno de defensa que las protege frente a las formas más tóxicas de la proteína tau, uno de los principales motores de la enfermedad que acaban degenerando en unos ovillos neurofibrilares que bloquean el transporte celular y provocan la muerte neurona.
Un servicio de limpieza contra la proteína defectuosa
Los autores del trabajo, publicado en la revista Cell, han identificado un mecanismo celular que marca la diferencia entre vulnerabilidad y resistencia en el alzhéimer y otras tauopatías, esto es, procesos neurodegenerativos asociadas con la citada agregación patológica de proteínas tau en el cerebro humano. Los investigadores han demostrado que un complejo molecular actúa como un servicio de limpieza especializado que etiqueta la proteína tau dañina para su eliminación.
Cuando este sistema funciona correctamente, las neuronas resisten mejor el avance de la enfermedad. Cuando falla, la acumulación de tau tóxica se acelera y la degeneración neuronal se vuelve inevitable.
🗣️ «Queríamos entender por qué algunas neuronas son vulnerables a la acumulación de tau, mientras que otras son más resistentes», explica Avi Samelson, primer autor del estudio y profesor de Neurología en la UCLA Health.
Qué es la proteína tau y para qué sirve
La proteína tau es una pieza clave del andamiaje interno de las neuronas. En condiciones normales, ayuda a estabilizar los microtúbulos, las estructuras que permiten el transporte de nutrientes y señales dentro de la célula. El problema aparece cuando la tau se pliega mal, se agrupa y forma agregados. En el alzhéimer, estas acumulaciones adoptan diversas formas, desde pequeños oligómeros —considerados especialmente tóxicos— hasta los conocidos ovillos neurofibrilares. No todas las neuronas, sin embargo, reaccionan igual ante esta amenaza.
Para investigar qué determina esa diferencia, el equipo de neurocientíficos utilizó neuronas humanas obtenidas a partir de células madre pluripotentes inducidas (iPSC). Estas neuronas, cultivadas en el laboratorio, portaban una mutación en el gen MAPT asociada a demencia frontotemporal, pero que genera agregados de tau estructuralmente idénticos a los observados en el alzheimer esporádico (la forma más común de la enfermedad de Alzheimer (más del 90% de los casos) y no está causada por una mutación genética heredada, sino por una combinación de edad, factores de riesgo genéticos, ambientales y de estilo de vida.).
Este modelo permitió estudiar, en un entorno humano y controlado, cómo se regula la acumulación de tau tóxica dentro de las neuronas.
Un cribado genético masivo con tecnología CRISPR
El enfoque fue ambicioso: un cribado genético a escala de todo el genoma humano utilizando tecnología de edición génica CRISPR, conocida popularmente como cortapega genético. En esencia, los investigadores fueron apagando uno a uno miles de genes para observar cuáles influían en la acumulación de oligómeros de tau.
El resultado fue un mapa detallado de los sistemas celulares que controlan el equilibrio entre producción, degradación y eliminación de esta proteína.
«Al analizar de forma sistemática casi todos los genes del genoma humano, encontramos tanto vías esperadas como otras completamente inesperadas que controlan los niveles de tau en las neuronas», señala Samelson.
CRL5-SOCS4: el sistema celular que elimina la tau tóxica
Entre los avances más destacados de este trabajo es que apareció un complejo enzimático llamado CRL5-SOCS4. Se trata de una ligasa E3 de ubiquitina, una de las enzimas encargadas de marcar proteínas para su destrucción. Su función es colocar pequeñas etiquetas moleculares —ubiquitinas— sobre las unidades de proteína tau, que indican que debe ser enviada al proteasoma, la trituradora de proteínas defectuosas de la célula.
Cuando los investigadores redujeron la actividad de este complejo, los niveles de tau aumentaron, especialmente en forma de oligómeros tóxicos. Cuando, por el contrario, estimularon su funcionamiento, las neuronas lograron mantener a raya la acumulación de tau.
El sistema actúa de forma muy específica: reconoce una región concreta de la proteína tau y dirige su degradación antes de que pueda agregarse.
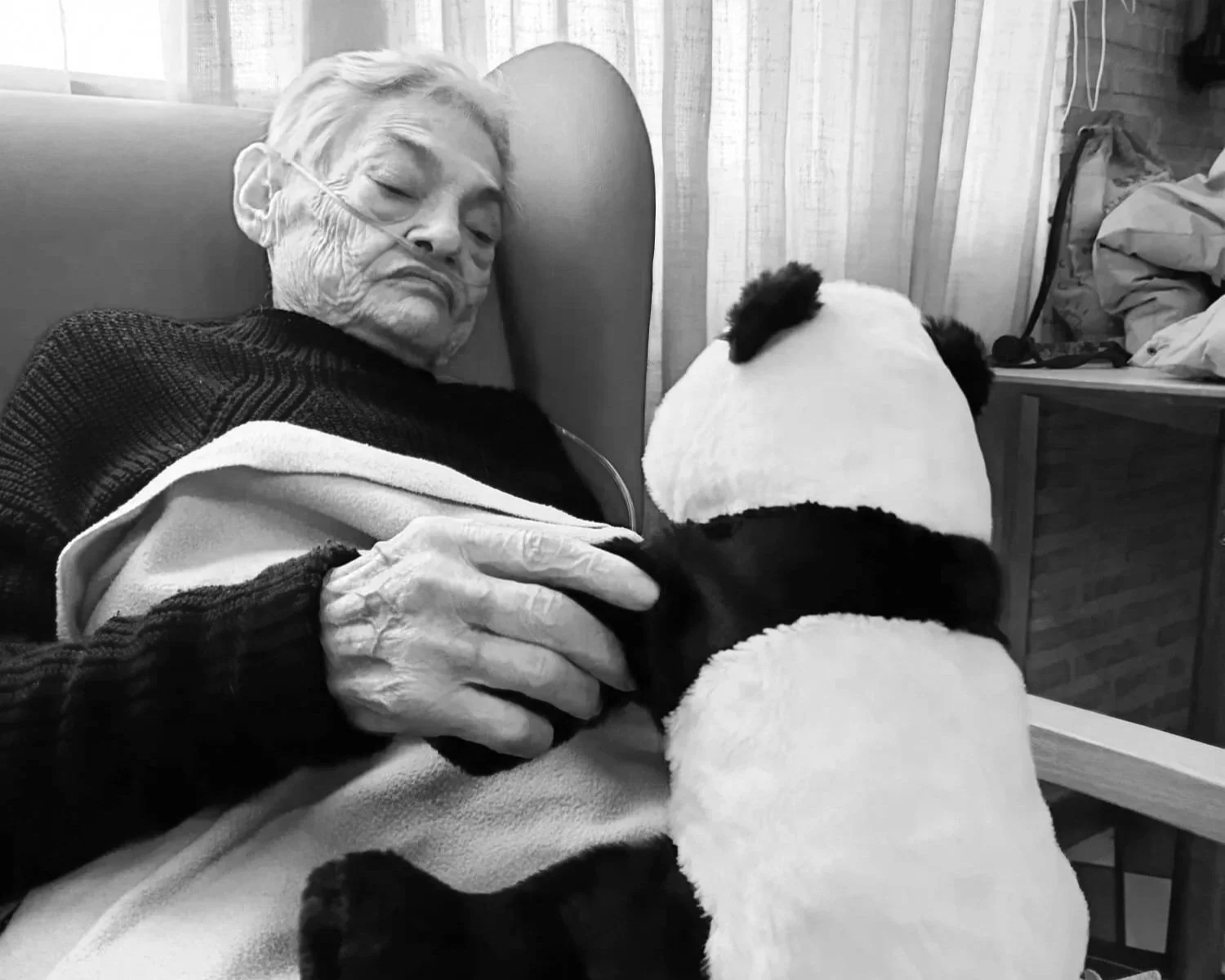
Una mujer con enfermedad de alzhéimer. Un estudio reciente ha descubierto que algunas neuronas activan mecanismos de defensa capaces de protegerlas frente a la proteína tau tóxica, lo que ayuda a explicar por qué ciertas células cerebrales resisten mejor el avance de la enfermedad y abre nuevas vías para futuros tratamientos. Crédito: E. Coperías
Neuronas resistentes en cerebros humanos con alzhéimer
Lo más relevante es que este mecanismo no se limita al laboratorio. Al analizar datos de cerebros humanos post mortem, los científicos observaron que las neuronas más resistentes al alzhéimer expresan niveles más altos de los componentes de este complejo, en particular de la proteína CUL5.
Pero en regiones cerebrales donde la muerte neuronal es menor, este sistema de defensa aparece reforzado. La correlación se mantiene no solo en el alzhéimer, sino también en otras enfermedades neurodegenerativas asociadas a la proteína tau, como la demencia frontotemporal y la parálisis supranuclear progresiva.
Recordemos que demencia frontotemporal es una enfermedad neurodegenerativa que afecta sobre todo a los lóbulos frontal y temporal, lo que provoca cambios de conducta, personalidad o lenguaje, a menudo en personas más jóvenes que en el Alzheimer. Por su parte, la parálisis supranuclear progresiva, menos frecuente, causa problemas graves de equilibrio, rigidez y dificultad para mover los ojos, especialmente al mirar hacia abajo.
Estrés oxidativo, mitocondrias y fragmentos tóxicos de tau
Este hallazgo sugiere que la resistencia neuronal no es un misterio azaroso, sino el resultado de programas celulares concretos que pueden activarse o fallar. «No todas las neuronas están indefensas frente a tau», señalan los autores. Algunas disponen de herramientas moleculares que les permiten sobrevivir más tiempo, y esas herramientas podrían convertirse en dianas terapéuticas.
El estudio también arroja luz sobre otro factor clave en la progresión de la enfermedad: el estrés oxidativo. Los investigadores descubrieron que cuando las mitocondrias —las centrales energéticas de la célula— fallan, se incrementa la producción de especies reactivas de oxígeno. Este aumento de radicales libres daña el sistema de degradación proteica y provoca un procesamiento anómalo de tau.
«Este fragmento de tau parece generarse cuando las células experimentan estrés oxidativo, algo común en el envejecimiento y en la neurodegeneración —explica Samelson. Y añade—: Descubrimos que este estrés reduce la eficiencia del proteasoma, la máquina celular encargada de reciclar proteínas, lo que provoca que procese la tau de forma incorrecta».
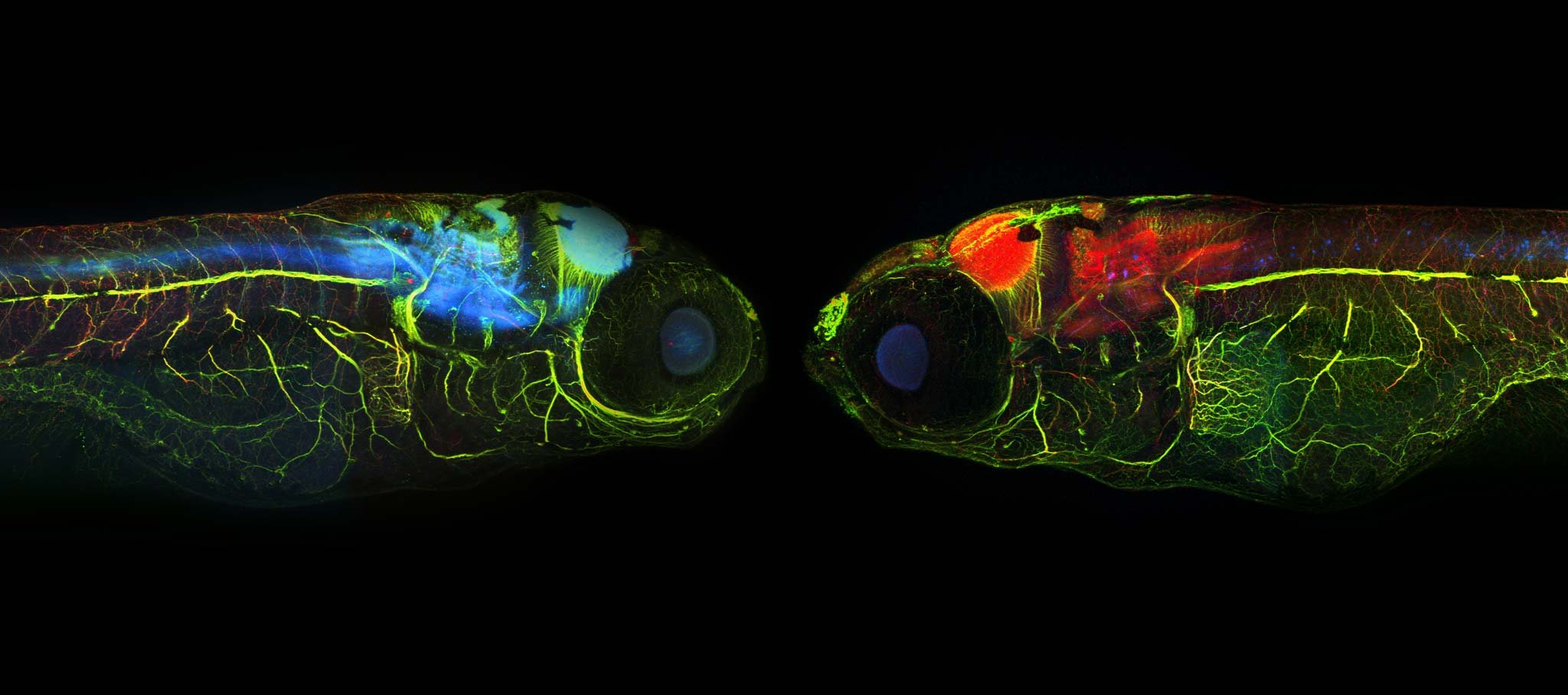
Modelo de alzhéimer en pez cebra, teñido para visualizar la proteína tau (rojo), las neuronas (verde), las sinapsis y la tau patológica (azul). Estos modelos permiten estudiar cómo se acumula la tau tóxica en el cerebro y por qué algunas neuronas logran resistir mejor el daño asociado a la enfermedad.
Cortesía: Dominik Paquet / Ludwig Maximilian University of Munich.
En estas condiciones, la célula genera un fragmento específico de tau, de unos 25 kilodaltons, que coincide con un biomarcador del alzhéimer presente en el líquido cefalorraquídeo y en la sangre de los pacientes. Este fragmento no solo se acumula dentro de la neurona, sino que se libera al exterior, donde puede favorecer la propagación de la patología entre células.
El origen de este fragmento no está en una proteasa clásica, sino en un proteasoma dañado por el estrés oxidativo. En lugar de destruir completamente la proteína tau, el sistema la corta de forma defectuosa, generando una versión truncada con un alto potencial patológico. Es una demostración directa de cómo el envejecimiento celular y el deterioro metabólico pueden alimentar el proceso neurodegenerativo.
En conjunto, los resultados dibujan un escenario coherente: la acumulación de tau tóxica no depende solo de cuánto se produce, sino de la capacidad de la neurona para eliminarla correctamente. Sistemas como el complejo CRL5-SOCS4 actúan como barreras de contención. Cuando estas barreras se debilitan —por mutaciones, estrés oxidativo o envejecimiento—, la enfermedad avanza.
Qué implicaciones tiene este hallazgo para futuros tratamientos
El hallazgo abre nuevas vías para el desarrollo de tratamientos para esta demencia. Hasta ahora, muchos ensayos clínicos han fracasado al intentar eliminar tau una vez que los ovillos ya están formados. Este estudio sugiere un cambio de enfoque terapéutico: reforzar los mecanismos naturales de defensa de las neuronas antes de que el daño sea irreversible. Activar o potenciar ligasas específicas, mejorar la función del proteasoma o reducir el estrés oxidativo podrían ser estrategias terapéuticas más eficaces.
🗣️ «Lo que hace que este estudio sea especialmente valioso es que utilizamos neuronas humanas que portan una mutación real causante de enfermedad —subraya Samelson. Y concluye—: Estas células presentan de forma natural diferencias en el procesamiento de tau, lo que nos da confianza en que los mecanismos que identificamos son relevantes para la enfermedad humana».
Aunque los autores subrayan que aún se trata de investigación básica, el valor del trabajo reside en haber identificado un mecanismo claro, validado tanto en neuronas humanas como en datos de pacientes. En un campo marcado por resultados ambiguos, esta claridad es poco común.
El alzhéimer sigue siendo una enfermedad neurodegenerativa devastadora, pero estudios como este muestran que no todo está perdido en el cerebro que envejece. Algunas neuronas saben defenderse. Ahora, la ciencia empieza a entender cómo lo hacen y, con ello, a imaginar nuevos tratamientos que no solo frenen la enfermedad, sino que ayuden a las células a resistirla.▪️(31-enero-2026)
Información facilitada por la UCLA Health
Fuente: Samelson, Avi J. et al. CRISPR screens in iPSC-derived neurons reveal principles of tau proteostasis. Cell (2026). DOI: 10.1016/j.cell.2025.12.038