Cómo una herramienta defectuosa de reparación del ADN acelera el envejecimiento y provoca inflamación crónica
Cuando el sistema que protege nuestro ADN falla, el daño no se queda en el núcleo de la célula. Un equipo de científicos ha descubierto que esa avería activa la inflamación y acelera el envejecimiento, lo que conecta por primera vez la reparación genética, el sistema inmunitario y la esperanza de vida.
Por Enrique Coperías, periodista científico
Ilustración conceptual de una célula en la que el ADN y las proteínas aparecen humanizados: cuando falla la enzima SPRTN, encargada de reparar daños genéticos, el material genético se acumula y desencadena inflamación crónica y envejecimiento prematuro, un proceso clave en el síndrome de Ruijs-Aalfs. Crédito: IA-DSALL-E-RexMolón Producciones
El ADN, una molécula vulnerable
Una herramienta clave de reparación del ADN que de repente deja de funcionar puede acelerar el envejecimiento del organismo y provocar inflamación crónica, además de malformaciones del desarrollo.
Es la principal conclusión de un estudio científico liderado por investigadores de la Universidad Goethe de Fráncfort, en Alemania, que aporta nuevas pistas sobre el origen del síndrome de Ruijs-Aalfs, una enfermedad genética en la que los afectados manifiestan, entre otros síntomas, rasgos de envejecimiento prematuro (progeroides), y abre posibles vías terapéuticas para esta y otras enfermedades genéticas raras.
Aunque el ADN se encuentra fuertemente empaquetado y protegido en el núcleo celular, la molécula de la videa está sometida de forma constante a daños genéticos. Los propios procesos metabólicos, así como factores externos, caso de la radiación y determinadas sustancias químicas, generan daños que, si no se reparan de manera eficaz, pueden tener consecuencias devastadoras para las células y los tejidos.
👉 La acumulación de errores genéticos está detrás del cáncer, del envejecimiento y de múltiples enfermedades degenerativas.
Los enlaces ADN-proteína, un daño especialmente peligroso
Entre las lesiones más peligrosas se encuentran los llamados enlaces ADN-proteína, conocidos por sus siglas en inglés como DPC. En estos casos, ciertas proteínas quedan unidas al ADN e interfieren gravemente en procesos biológicos esenciales. Es el caso de la replicación celular.
Estos enlaces pueden aparecer tras el consumo de alcohol, la exposición a aldehídos ,como el formaldehído, o por fallos de las propias enzimas encargadas de copiar y reparar el material genético.
Cuando se producen estos incidentes genéticos, el riesgo para la estabilidad del genoma es alto.
SPRTN: la enzima que evita el colapso celular
Para eliminar estos enlaces tóxicos, las células cuentan con una enzima de reparación especializada llamada SPRTN, cuya función es cortar y retirar los complejos ADN-proteína. Sin embargo, cuando SPRTN no funciona correctamente —por ejemplo, debido a mutaciones genéticas— las consecuencias son graves.
En los seres humanos, estos fallos se asocian a deformidades óseas y a un mayor riesgo de cáncer de hígado a edades tempranas, un conjunto de síntomas conocido como síndrome de Ruijs-Aalfs, una enfermedad rara para la que hoy no existen tratamientos específicos y cuyo mecanismo molecular apenas se comprendía hasta bien poco.
El equipo dirigido por el bioquímico croata Ivan Đikić, del Instituto de Bioquímica II de la Universidad Goethe, ha ido un paso más allá. Mediante experimentos con cultivos celulares y ratones modificados genéticamente, los investigadores observaron que la pérdida de una SPRTN funcional no solo provoca la acumulación de ADN dañado en el núcleo. De forma inesperada, parte de ese ADN acaba escapando al citoplasma, el interior de la célula fuera del núcleo.
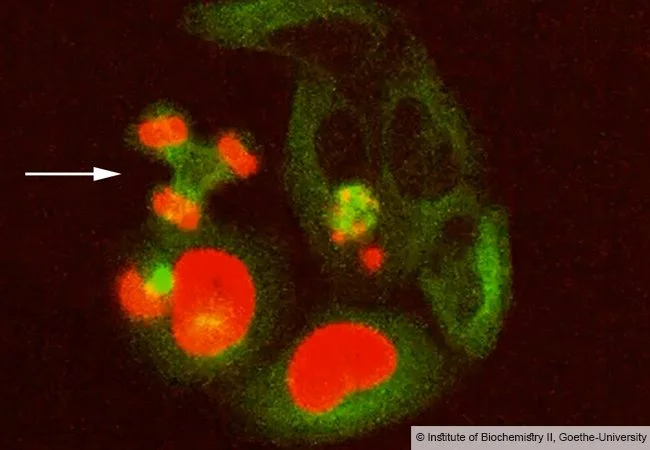
Error garrafal
El fallo de la enzima de reparación SPRTN en estas células en cultivo provoca errores letales en la división celular, como la distribución incorrecta de los cromosomas (en rojo) entre tres núcleos hijos en lugar de dos (flecha). En verde, el aparato de división celular y el citoesqueleto. Cortesía: Instituto de Bioquímica II / Universidad Goethe de Fráncfort.
Cuando el ADN dañado activa el sistema inmunitario
La presencia de ADN en el citoplasma es interpretada por la célula como una señal de peligro. Normalmente, ese ADN procede de virus, bacterias o de procesos de transformación maligna. Por ello, su detección activa potentes mecanismos defensivos, en particular la vía de señalización cGAS-STING, que desencadena la producción de mensajeros químicos y la llamada de aviso a células del sistema inmunitario. El resultado es una respuesta inflamatoria persistente.
Los investigadores comprobaron que esta inflamación crónica es especialmente intensa durante el desarrollo embrionario de los ratones y se mantiene en la edad adulta, sobre todo en órganos como el pulmón y el hígado.
Como consecuencia, muchos animales mueren de forma prematura o muestran signos claros de envejecimiento acelerado, muy similares a los observados en pacientes con síndrome de Ruijs-Aalfs. Cuando los científicos bloquearon farmacológicamente esta respuesta inmunitaria, buena parte de los síntomas se atenuaron.
🗣️ «Los enlaces ADN-proteína que no se reparan tienen consecuencias sistémicas mucho más amplias —explica Đikić. Y añade—: No solo comprometen la estabilidad del genoma, sino que además impulsan una inflamación crónica que puede influir de forma decisiva en la esperanza de vida».
Implicaciones médicas y terapéuticas
Este investigador, médico y biólogo molecular, ve en estos resultados una oportunidad para el desarrollo de terapias. «Además del síndrome de Ruijs-Aalfs, existen otras enfermedades genéticas raras en las que los enlaces ADN-proteína desempeñan un papel importante. Con nuestro trabajo hemos sentado una base fundamental para futuros enfoques terapéuticos», comenta ilusionado.
En palabras de Đikić, «al estudiar los mecanismos moleculares de estas enfermedades poco frecuentes, se ha descubierto un nuevo vínculo entre el daño en el ADN, las respuestas inflamatorias y la longevidad de un organismo. Esto también contribuye a entender mejor la biología del envejecimiento».
El proyecto ha contado con la colaboración de numerosos centros de investigación internacionales, entre ellos la Universidad Johannes Gutenberg de Maguncia, el Consorcio Alemán para la Investigación Traslacional del Cáncer, el Centro Alemán de Investigación del Cáncer, la EPFL de Lausana, el hospital Charité de Berlín y universidades europeas de Colonia y Split, en Croacia, en el marco de la alianza universitaria Rin-Main.▪️(31-enero-2026)
Información facilitada por la Universidad Goethe de Fráncfort
Fuente: Ines Tomaskovic et al. DNA-protein cross-links promote cGAS-STING–driven premature aging and embryonic lethality. Science (2026). DOI: