Un pinchazo de luz para medir el azúcar: el camino hacia las pruebas clínicas sin sangre
Medir la glucosa sin extraer sangre ya no es solo una promesa tecnológica. Un nuevo dispositivo de microagujas ópticas logra cuantificar el azúcar directamente bajo la piel, lo que abre la puerta a pruebas clínicas menos invasivas y más precisas.
Por Enrique Coperías, periodista científico
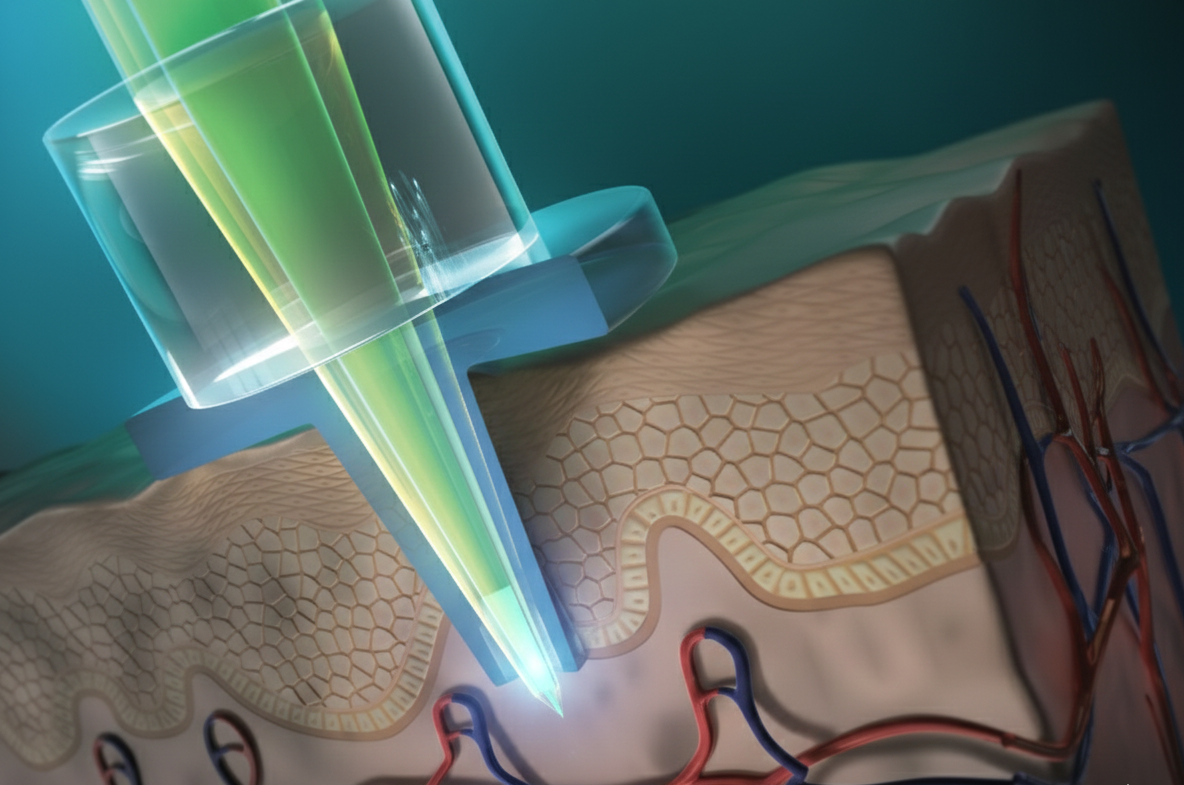
Ilustración del funcionamiento del primer dispositivo óptico de microagujas capaz de cuantificar la concentración de glucosa en volúmenes ultrabajos, del orden de subnanolitros, directamente en el líquido intersticial de la piel. En su extremo, una diminuta cavidad alberga un hidrogel fluorescente sensible a la glucosa. Crédito: IA-Geminis-RexMolón Producciones
Aún hoy, la sangre resulta clave para el diagnóstico médico, porque actúa como un espejo del estado interno del cuerpo. En una sola muestra pueden detectarse, entre otras cosas, infecciones, inflamación, alteraciones hormonales, problemas metabólicos, fallos de órganos y enfermedades genéticas, ya que transporta células, nutrientes, desechos y señales químicas que reflejan cómo funciona cada sistema orgánico.
Pinchar, extraer, analizar. Pero la medicina del siglo XXI empieza a cuestionar ese ritual. ¿Y si fuera posible medir biomarcadores relevantes sin necesidad de sacar ni una gota de sangre? Un equipo internacional de investigadores acaba de dar un paso decisivo en esa dirección con el desarrollo del primer dispositivo óptico de microagujas capaz de cuantificar la concentración de glucosa en volúmenes ultrabajos, del orden de subnanolitros, directamente en el líquido intersticial de la piel.
El avance, publicado en el Journal of Materials Chemistry B, combina ingeniería de materiales, óptica y química supramolecular para crear una microaguja transparente que actúa como guía de luz y sensor químico a la vez. En su extremo, una diminuta cavidad alberga un hidrogel fluorescente sensible a la glucosa.
El resultado es un sistema mínimamente invasivo que permite medir concentraciones de glucosa con errores comparables a los de los glucómetros comerciales, pero sin consumo de la molécula analizada y sin extracción de fluidos.
Qué es el líquido intersticial y por qué es clave
El líquido intersticial —el fluido que baña las células y circula entre los vasos sanguíneos— lleva décadas en el punto de mira de la investigación biomédica. Contiene glucosa, electrolitos, hormonas y proteínas que reflejan el estado fisiológico del organismo. De hecho, los sistemas de monitorización continua de glucosa ya se basan en este fluido.
El problema es que acceder al líquido intersticial de forma fiable no es sencillo: extraerlo altera el equilibrio de presiones de la piel y, cuando las muestras son extremadamente pequeñas, los métodos clásicos dejan de ser precisos.
Ahí surge una limitación nada desdeñable. La mayoría de los sensores bioquímicos utilizan reacciones enzimáticas que consumen el analito que miden; el analito es una sustancia (elemento, compuesto o ion) específica que se desea identificar, detectar o cuantificar dentro de una muestra. En un volumen de apenas una fracción de nanolitro, ese consumo introduce errores significativos.
👉 «Si la medición altera lo que se quiere medir, la fiabilidad del diagnóstico se resiente —señalan los autores—. La alternativa pasa por técnicas ópticas que detecten la presencia de la molécula sin destruirla».
Cómo funcionan las microagujas ópticas
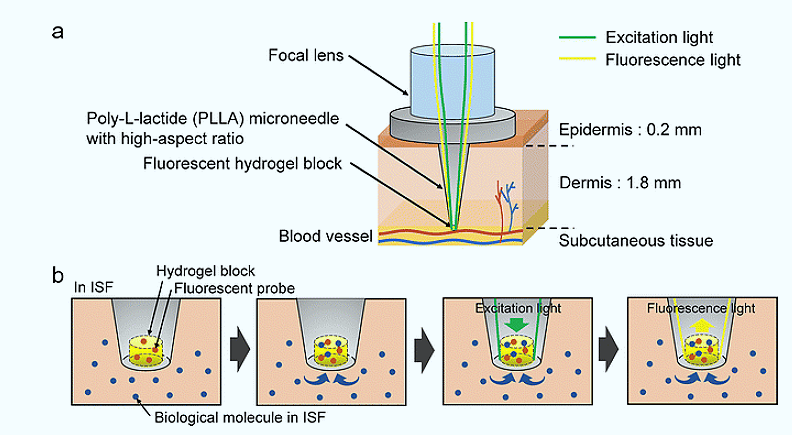
El dispositivo desarrollado por el equipo liderado desde la Universidad de Tokio, en Japón, es, en esencia, una microaguja de dos milímetros de longitud fabricada en ácido poli-L-láctico (PLLA), un polímero biodegradable y biocompatible ampliamente usado en medicina. Pero no es una aguja cualquiera.
En efecto, gracias a un cuidadoso control de su estructura interna, el material se mantiene en estado amorfo y altamente transparente, lo que permite que la aguja funcione como una guía de onda óptica, según Masahiro Fukuhara, coautor del estudio que trabaja en el Departamento de Ingeniería de Materiales, en la Facultad de Ingeniería de la Universidad de Tokio.
La microaguja se integra con una lente de gradiente de índice (GRIN) que enfoca la luz ultravioleta exactamente en su punta. Allí se encuentra el corazón del sistema: un bloque de hidrogel fluorescente de apenas 0,79 nanolitros de volumen, alojado en una cavidad microscópica tallada en el extremo de la aguja.
Cuando la aguja penetra en la piel, alcanza el líquido intersticial cercano al plexo vascular de la dermis. La glucosa del entorno difunde rápidamente hacia el hidrogel. Al iluminarlo, el sistema detecta cambios en la intensidad de la fluorescencia que dependen directamente de la concentración de glucosa presente.
Microaguja óptica de PLLA con un hidrogel fluorescente en la punta. El dispositivo, de apenas dos milímetros de longitud, integra un diminuto bloque de hidrogel —con un volumen inferior a un nanolitro— que permite captar moléculas del líquido intersticial por difusión y analizarlas directamente bajo la piel mediante sensores ópticos. Cortesía: Takehara’s Lab, University of Tokyo
El papel del hidrogel fluorescente y el ácido borónico
La clave de la detección reside en la química del hidrogel. Este material incorpora monómeros basados en ácido borónico, una familia de compuestos conocida por su capacidad para unirse de forma reversible a los azúcares.
En este caso, el ácido borónico está integrado en una molécula fluorescente derivada del antraceno, un hidrocarburo aromático policíclico (HAP) sólido, de incoloro a amarillento, que se encuentra en el alquitrán de hulla y se reconoce por su brillante fluorescencia azul bajo luz ultravioleta.
Cuando la glucosa se une al ácido borónico, modifica el entorno electrónico del fluoróforo y altera su intensidad de la emisión. No hay reacción irreversible ni consumo de glucosa: el proceso es dinámico y reversible, lo que permite mediciones repetidas y estables en el tiempo. Según los experimentos descritos en el artículo, la relación entre fluorescencia y concentración de glucosa muestra una buena correlación, con un coeficiente de determinación de 0,93 en las curvas de calibración.
Precisión clínica en volúmenes ultrabajos
En palabras de Hiroaki Takehara, autor principal del trabajo y director del Centro de Innovación de Nanomedicina, en el Instituto de Promoción Industrial de Kawasaki. Uno de los logros más llamativos del trabajo es demostrar que se puede medir glucosa con precisión clínica en un volumen inferior a un nanolitro.
En pruebas realizadas con soluciones estándar, el sistema registró errores medios del 5,6 % en un rango de concentraciones de 6,1 a 37,5 milimolar. Para ponerlo en contexto, la normativa internacional para glucómetros de autocontrol exige que el 95 % de las mediciones estén dentro de un margen de error del 15 % a partir de 5,6 milimolar.
Además, las simulaciones numéricas muestran que el sensor responde en apenas tres minutos y que la medición es altamente localizada: la lectura refleja la concentración de glucosa en un radio de unos 200 micrómetros alrededor de la punta de la aguja. Esto abre la puerta a estudios de microentornos tisulares, algo impensable con técnicas convencionales.
Dispositivo de microaguja de PLLA ya fabricado, comparable en longitud a la cabeza de una cerilla. Las imágenes de microscopía electrónica muestran el extremo de la microaguja, donde una cavidad microscópica permite alojar el hidrogel sensor que hace posible la medición de biomarcadores directamente bajo la piel. Cortesía: Takehara’s Lab, University of Tokyo
Aplicaciones más allá de la diabetes
Aunque la demostración se ha centrado en la glucosa, por su relevancia clínica inmediata en la diabetes, enfermedad que afecta a más de 800 millones de personas en todo el mundo, los autores subrayan que el concepto es mucho más amplio.
El hidrogel puede modificarse para incorporar otros sensores ópticos sensibles a diferentes biomarcadores: lactato, electrolitos, hormonas e incluso proteínas asociadas a procesos inflamatorios o inmunitarios.
👉 «El dispositivo no está limitado a un solo analito —explican—. Al cambiar la sonda fluorescente, se puede adaptar a distintas aplicaciones diagnósticas”. En ese sentido, la microaguja óptica se plantea como una plataforma tecnológica versátil más que como un sensor único».
Hacia una medicina mínimamente invasiva
El trabajo se sitúa en una tendencia más amplia hacia dispositivos médicos mínimamente invasivos, portátiles y continuos. Frente a los parches actuales de monitorización, que combinan agujas flexibles y sensores electroquímicos, la detección óptica ofrece ventajas importantes: no consume el analito, reduce la deriva del sensor y permite miniaturizar aún más el volumen de medición.
Quedan, eso sí, retos por resolver antes de una aplicación clínica real. En esta primera demostración, las mediciones se realizaron en condiciones de pH ligeramente alcalino, no idénticas a las del líquido intersticial humano. Será necesario optimizar las sondas químicas para funcionar en condiciones fisiológicas y evaluar la estabilidad a largo plazo del sistema en contacto con tejido vivo.
Aun así, el avance es significativo. Por primera vez, se ha demostrado que es posible cuantificar glucosa de forma óptica, precisa y no consumptiva en volúmenes ultrabajos que rozan el límite físico de lo medible. Un pinchazo casi indoloro, que no extrae sangre ni fluido alguno, pero que deja pasar la luz suficiente para revelar lo que ocurre bajo la piel.
Si la sangre ha sido durante décadas la protagonista indiscutible del diagnóstico clínico, tecnologías como esta apuntan a un futuro de pruebas médicas sin extracción de sangre, en el que bastará con iluminar el cuerpo desde dentro para leer sus señales químicas. Un futuro donde el análisis no deje huella visible, salvo quizá un destello azul en la punta de una microaguja.▪️
Información facilitada por el Centro de Innovación en Nanomedicina
Fuente: Masahiro Fukuhara, Hiroaki Takehara, Kevin Barthelmes, Benjamin Kersch-Hunt, Jordan E. Gardiner, Yukihiro Kanda, Akira Matsumoto, Tony D. James and Takanori Ichiki. Development of an optical microneedle device embedding sub-nanoliter volumes of boronic acid-based fluorescent hydrogel. Journal of Materials Chemistry (2025). DOI: 10.1039/D5TB00385G