Diseñan unas «nanoflores» que rejuvenecen las células humanas viejas y dañadas sustituyendo sus mitocondrias
Unas diminutas estructuras están logrando lo que antes parecía ciencia ficción: devolver energía y vitalidad a células humanas envejecidas. Estas «nanoflores» actúan como cargadores biológicos capaces de reemplazar a las mitocondrias dañadas y reencender las centrales energéticas del organismo.
Por Enrique Coperías
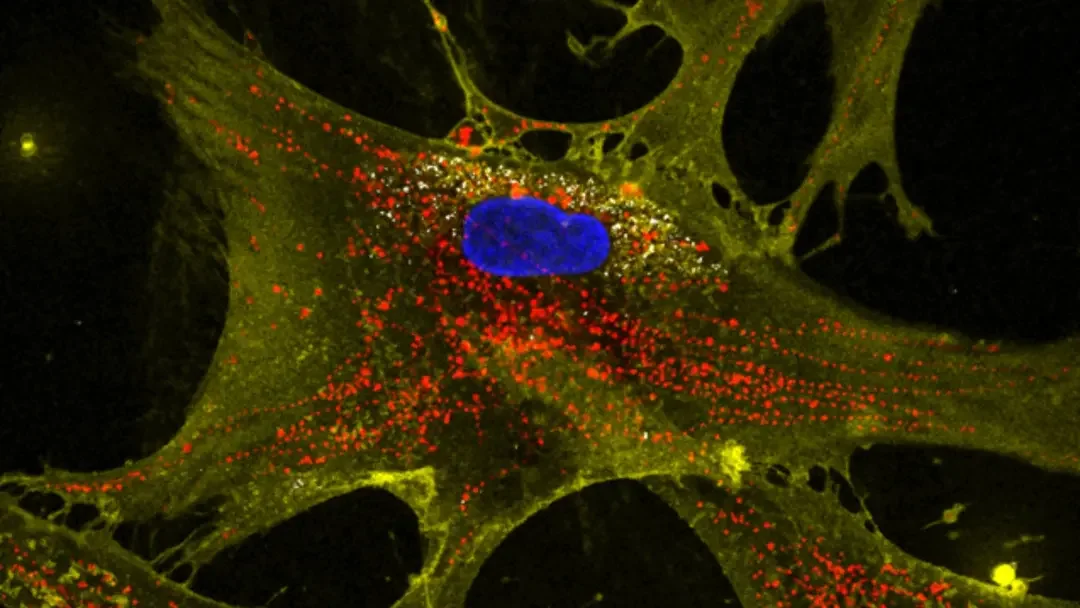
Imagen microscópica que muestra cómo las nanoflores (blanco) ayudan a que las células sanas (amarillo) transfieran mitocondrias productoras de energía (rojo) a las células vecinas. Los núcleos aparecen teñidos en azul. Cortesía: Dr. Akhilesh K. Gaharwar.
La medicina regenerativa podría estar a punto de sumar una herramienta inesperada a su arsenal terapéutico: unas diminutas flores nanotecnológicas de molibdeno y azufre, construidas átomo a átomo, capaces de convertir células madre en auténticas fábricas de mitocondrias, las centrales energéticas de la célula.
El hallazgo, publicado en la revista PNAS, propone una vía novedosa para reparar tejidos dañados y abordar enfermedades donde la energía celular se derrumba, desde trastornos metabólicos hasta cardiopatías y graves daños tisulares.
Las protagonistas de este avance son unas nanopartículas de disulfuro de molibdeno (MoS₂) diseñadas con un detalle extremo: sus láminas presentan diminutas vacantes atómicas que alteran su química y les confieren un comportamiento singular. Cuando entran en contacto con células madre mesenquimales humanas, desencadenan una reacción en cadena que multiplica la biogénesis mitocondrial, es decir, la creación de nuevas mitocondrias. En apenas una semana, estas células duplican su contenido mitocondrial y aumentan de manera notable la capacidad de transferir dichas mitocondrias a células envejecidas o dañadas necesitadas de energía.
🗣️ «Hemos entrenado a las células sanas para que compartan sus baterías de repuesto con las más débiles —asegura Akhilesh K. Gaharwar, uno de los responsables del estudio y miembro del Departamento de Ingeniería Biomédica, en la Texas A&M University (Estados Unidos). Y añade—: Al aumentar el número de mitocondrias dentro de las células donantes, podemos ayudar a que las células envejecidas o dañadas recuperen su vitalidad, sin necesidad de modificación genética ni medicamentos».
Ese intercambio natural de mitocondrias entre células, descubierto hace poco más de una década, se ha convertido en un campo emergente en biomedicina. El cuerpo lo utiliza como mecanismo de rescate: cuando una célula cercana está dañada o sufre estrés metabólico, otras pueden enviarle mitocondrias sanas mediante finos puentes de citoplasma conocidos como nanotúneles (TNT). Pero el proceso es lento y muy ineficiente. La nueva investigación muestra que, con un pequeño empujón nanotecnológico, puede dispararse de forma extraordinaria.
Cómo funcionan las nanoflores MoS₂ en células madre
Las nanopartículas desarrolladas por el equipo de John Soukar, de la Texas A&M University, presentan un aspecto sorprendentemente orgánico: parecen nanoflores en miniatura compuestas por múltiples láminas que se superponen formando una estructura tridimensional muy estable. Dependiendo de la temperatura y el tiempo de síntesis, estas nanoflores pueden medir entre 50 y 250 nanómetros de diámetro.
Los investigadores observaron que las partículas más pequeñas —en torno a los100 nanómetros— se internalizan con mayor facilidad en las células y tienen un efecto especialmente notable en la activación de las rutas que controlan la biogénesis mitocondrial.
El mecanismo molecular resulta muy revelador. Las nanoflores con vacantes atómicas actúan como potentes atrapadores de especies reactivas de oxígeno (ROS), unas moléculas que se acumulan en situaciones de estrés celular y que, paradójicamente, sirven como señal para activar rutas compensatorias.
Al reducir los ROS, las nanopartículas activan una cascada bioquímica que involucra a la proteína SIRT1 y al coactivador transcripcional PGC-1α, considerados los dos grandes reguladores maestros de la producción de nuevas mitocondrias. Este es el mismo eje molecular que se activa durante el ejercicio intenso o la restricción calórica, dos condiciones fisiológicas que incrementan la demanda energética del organismo.
La activación de PGC-1α dispara a su vez la expresión de genes como el TFAM y el VDAC, que son fundamentales para replicar ADN mitocondrial y ensamblar correctamente las estructuras energéticas de la célula. El resultado es un aumento aproximado del doble en el número de copias de ADN mitocondrial, acompañado de una mejora clara en la producción de ATP —el combustible universal de los procesos biológicos— y en la capacidad respiratoria mitocondrial medida mediante analizadores de flujo extracelular.
Transferencia mitocondrial amplificada con resultados sin precedente
Una vez convertidas en biofactorías energéticas, las células madre mesenquimales —células madre adultas que pueden convertirse en varios tipos de tejidos, como hueso, cartílago, grasa o músculo, y que además ayudan a reparar y modular la respuesta inmunitaria— amplifican de forma espectacular su capacidad de donar mitocondrias.
En condiciones normales, estas células pueden transferir parte de sus mitocondrias a otras células dañadas a través de los citados nanotúneles citoplasmáticos, pero la tasa de transferencia es baja. Sin embargo, cuando las células madre han sido pretratadas con las nanoflores, el proceso cambia drásticamente.
En experimentos de cocultivo, los investigadores observaron mediante videomicroscopía que las células tratadas comenzaban a enviar mitocondrias a células musculares lisas y a cardiomiocitos —las células musculares que forman el corazón— en las primeras horas de contacto, mucho antes de lo habitual. La transferencia no solo era más rápida, sino también mucho más intensa: entre dos y cuatro veces superior según el tipo de célula receptora.
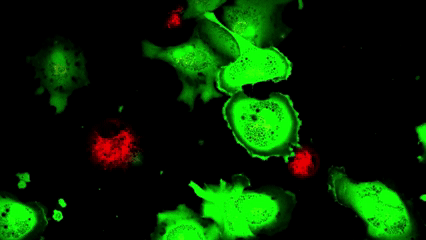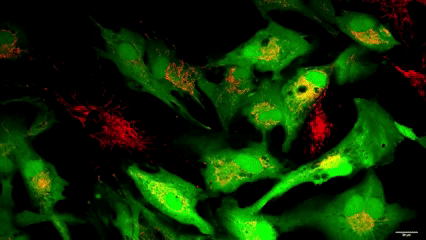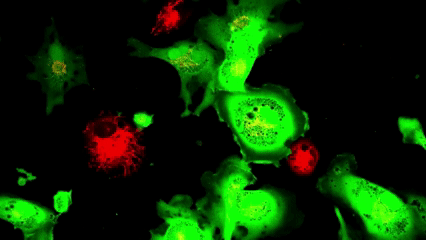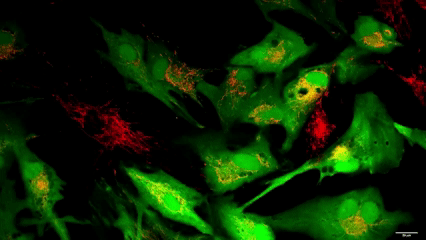
La trasferencia de «baterías celulares»
Visualización del proceso de transferencia mitocondrial a lo largo de 16 horas. Las células musculares lisas receptoras (CellTracker verde) interactúan con las células donantes MitoFactories (MitoTracker Red FM)
Las nanopartículas no modifican la maquinaria de transporte celular
🗣️El propio Soukar describe el fenómeno con una metáfora muy gráfica: «el aumento de eficiencia, multiplicado por varios factores, fue más de lo que esperábamos. Es como darle a un aparato viejo un nuevo paquete de baterías. En lugar de tirarlo, estamos conectando baterías totalmente cargadas de células sanas a células enfermas».
Lo más notable del descubrimiento es que las nanopartículas no modifican la maquinaria de transporte celular. Proteínas clave, como la Miro1, encargadas de mover las mitocondrias a lo largo del citoesqueleto, mantienen su expresión estable. Lo que cambia es el inventario disponible: con muchas más mitocondrias listas para ser donadas, la célula incrementa su capacidad de transferencia sin necesidad de alterar su arquitectura interna. Es un simple efecto de oferta: más producción, más disponibilidad para transferir.
La investigación también confirma que la transferencia depende estrictamente de los nanotúneles. Cuando se bloquea la formación de estas estructuras con fármacos inhibidores de la polimerización de actina, el intercambio se detiene por completo.
Reparación de células dañadas y recuperación funcional
Pero ¿sirve este aumento de transferencia para algo más que un fenómeno curioso en placas de cultivo? Los investigadores sometieron a distintas células, especialmente cardiacas y musculares lisas, a químicos que dañan con contundencia sus mitocondrias, como la antimiocina A, el CCCP y el quimioterápico doxorrubicina.
Estas sustancias reducen de forma drástica la producción de adenosín trifosfato (ATP) —un nucleótido fundamental en la obtención de energía celular— y desencadenan cascadas de apoptosis o muertes celulares programadas, un proceso natural de autodestrucción mediante el cual una célula se elimina de forma ordenada cuando está dañada, ya no es necesaria o puede causar problemas. En ese contexto tóxico, las células que recibieron mitocondrias de las células madre mesenquimatosas humanas tratadas con MoS₂ recuperaron parte de su respiración normal, aumentaron su producción energética y mostraron una notable reducción de marcadores de muerte celular.
En términos de fisiología básica, lo que se observa es que los orgánulos transferidos no solo se integran físicamente en la célula receptora, sino que funcionan adecuadamente y pueden compensar el fallo energético producido por la agresión química. Incluso en células cardíacas humanas, altamente dependientes del metabolismo oxidativo, la recuperación es significativa.
Las mitocodrias receptoras aceptan el nuevo ADN sin modificarlo
Los investigadores también quisieron saber qué ocurre a nivel genético dentro de las células que reciben estas mitocondrias suplementarias. Mediante análisis de una herramienta conocida como transcriptómica completa, que detecta todas las moléculas de ARN que produce una célula o un tejido en un momento dado, vieron que las células musculares lisas sometidas a una transferencia intensificada, lo que los autores denominan MitoFactory-transfer, activan un amplio repertorio de genes relacionados con el metabolismo celular, la respiración, la cadena de transporte de electrones y la formación de complejos mitocondriales.
En cambio, los genes codificados en el propio ADN mitocondrial, un pequeño genoma circular heredado casi intacto de nuestras madres y que se aloja en el interior de las mitocondrias, no se ven alterados.
Esto tiene una explicación lógica: la célula receptora no modifica el genoma de las mitocondrias entrantes, sino que adapta su propia maquinaria nuclear para integrarlas y sostenerlas adecuadamente. El resultado final es una célula metabólicamente más activa, con mayor capacidad de producción de energía y aparentemente más resistente al estrés.
Mitocondrias (verde) y ADN (amarillo) de una célula. Cortesía: Muthugapatti K. Kandasamy / The University of Georgia / Biomedical Microscopy Core / https://www.nikonsmallworld.com/
Aplicaciones potenciales en enfermedades degenerativas
Aunque el trabajo se ha desarrollado íntegramente en sistemas celulares, sus implicaciones son profundas. La disfunción mitocondrial está en el centro de enfermedades neurodegenerativas, miopatías, cardiopatías, trastornos metabólicos hereditarios e incluso procesos de envejecimiento celular. Poder refrescar la población mitocondrial de células dañadas mediante un refuerzo externo abre posibilidades terapéuticas que hasta ahora parecían remotas.
🗣️ Gaharwar lo expresa con cautela pero también con ambición: «Este es un primer paso pero emocionante hacia la recarga de tejidos envejecidos utilizando su propia maquinaria biológica. Si logramos potenciar de forma segura este sistema natural de compartir energía, algún día podría ayudar a frenar o incluso revertir algunos efectos del envejecimiento celular».
A diferencia de otras técnicas experimentales que requieren manipulación genética o ingeniería celular avanzada, el método propuesto en PNAS es relativamente simple: tratar células madre con nanopartículas biocompatibles antes de administrarlas como terapia celular. Las células madre mesenquimatosas humanas ya están aprobadas y utilizadas en numerosos ensayos clínicos, lo que podría acelerar la traslación de esta estrategia a modelos animales y, eventualmente, a estudios en humanos.
¿Riesgos? Como siempre en nanotecnología médica, será necesario evaluar la seguridad a largo plazo, la distribución de las partículas en el organismo y posibles efectos inmunológicos. Pero el equipo autor del estudio subraya que, en cultivo, las nanoflores no alteran el ciclo celular ni la viabilidad de las células tratadas, siempre que se utilicen en concentraciones moderadas.
Un salto conceptual en la medicina mitocondrial
En síntesis, el estudio demuestra una idea poderosa: no es necesario forzar genéticamente a las células para que transfieran más mitocondrias. Basta con aumentar su capacidad de producción energética para que, de manera natural, donen más orgánulos cuando otras células los necesitan. La nanotecnología actúa aquí como un catalizador inteligente que desbloquea un mecanismo biológico subexplotado.
🗣️ «Podrías colocar las células en cualquier parte del paciente. Para una miocardiopatía, puedes tratar directamente las células cardíacas, colocando las células madre en el corazón o cerca de él— dice Soukar. Y continúa—: Si se trata de distrofia muscular, puedes inyectarlas directamente en el músculo. Es muy prometedor en cuanto a su uso en una gran variedad de casos, y esto es solo el comienzo. Podríamos trabajar en esto indefinidamente y encontrar cosas nuevas y nuevos tratamientos cada día».
Si futuros trabajos confirman estos resultados en organismos vivos, podríamos estar ante una plataforma terapéutica capaz de revitalizar células en decadencia y revertir daños antes considerados irreversibles. No sería exagerado decir que estas nanoflores microscópicas podrían convertirse en una de las herramientas más elegantes y prometedoras de la medicina regenerativa del siglo XXI. ▪️
Información facilitada por la Texas A&M University
Fuente: J. Soukar, K.A. Singh, A. Aviles, S. Hargett, H. Kaur, S. Foster, S. Roy, F. Zhao, V. M. Gohil, I. Singh & A. K. Gaharwar. Nanomaterial-induced mitochondrial biogenesis enhances intercellular mitochondrial transfer efficiency. PNAS (2025). DOI: https://doi.org/10.1073/pnas.2505237122