¿Pueden dos fármacos contra el cáncer ser la clave para tratar el alzhéimer?
Dos fármacos usados en el tratamiento del cáncer podrían convertirse en la próxima gran esperanza contra el alzhéimer. Un innovador estudio basado en inteligencia artificial y datos clínicos reales revela su potencial para revertir los daños cerebrales y recuperar la memoria.
Por Enrique Coperías
Un enfoque revolucionario basado en datos humanos reales y en la biología celular ha identificado una nueva terapia combinada que mejora la memoria y reduce otros síntomas del alzhéimer en modelos animales. El paso siguiente será comprobar si los dos fármacos, el letrozole y el irinotecán, funciona también en personas con esta demencia —arriba—. Foto: E. Coperías
El alzhéimer es, sin lugar a dudas, uno de los mayores retos de la medicina moderna. Esta enfermedad neurodegenerativa, que afecta a más de 50 millones de personas en todo el mundo y a cerca de un millón solo en España, deteriora progresivamente la memoria, el pensamiento y la capacidad de realizar tareas cotidianas.
A pesar de décadas de investigación y miles de millones invertidos, las terapias disponibles ofrecen beneficios muy limitados. Pero ahora, un nuevo estudio plantea una esperanza renovada.
Un equipo interdisciplinario de científicos de la Universidad de California en San Francisco (UCSF) y del Gladstone Institutes ha identificado una combinación de dos fármacos oncológicos — el letrozole y el irinotecán— que, en modelos animales, logra revertir alteraciones clave en el cerebro asociadas al alzhéimer.
Esta terapia farmacológica combinada no solo mejoró la memoria en ratones, sino que redujo la acumulación de proteínas tóxicas y restauró funciones neuronales dañadas por la enfermedad.
Lo más revolucionario de este hallazgo no es solo el uso de medicamentos existentes, sino la forma en que fueron seleccionados: mediante un sofisticado análisis computacional que integra datos moleculares humanos, bibliotecas farmacológicas y millones de registros clínicos electrónicos. Esta metodología, que se apoya en la inteligencia artificial (IA) y big data, marca un giro hacia una medicina de precisión mucho más personalizada y eficiente.
De la complejidad genética a una solución pragmática, en tres pasos
«El alzhéimer conlleva cambios complejos en el cerebro, lo que ha dificultado mucho su estudio y tratamiento —explica la doctora Marina Sirota, profesora de Pediatría, directora interina del Bakar Computational Health Sciences Institute de la UCSF y una de las autoras principales del estudio. Y añade—: Pero nuestras herramientas computacionales nos han permitido abordar esa complejidad directamente». Dicho abordaje puede resumirse en tres fases:
1️⃣ Análisis de expresión génica en células cerebrales humanas: el primer paso fue analizar cómo se alteran los patrones de expresión génica en células individuales del cerebro humano afectado por la enfermedad de Alzheimer. A partir de bases de datos públicas de estudios post mortem, el equipo reconstruyó una firma genética de la enfermedad en distintos tipos celulares. Estos incluyen neuronas excitatorias e inhibitorias y células gliales, como los astrocitos, la microglía y los oligodendrocitos.
2️⃣ Búsqueda de fármacos que reviertan esas alteraciones: estas firmas fueron después comparadas con una enorme base de datos llamada Connectivity Map, que contiene los efectos que provocan más de 1.300 medicamentos aprobados sobre la expresión génica en células humanas. El objetivo: encontrar fármacos que pudieran revertir las alteraciones características del alzhéimer.
3️⃣ Validación en datos clínicos reales: los científicos identificaron 86 medicamentos que mostraban capacidad para contrarrestar los efectos de la enfermedad en al menos un tipo celular, y veinticinco lo hicieron en varios tipos. Entre estos, solo diez estaban ya aprobados por la FDA, la Administración de Alimentos y Medicamentos estadounidense. Al analizar los datos de 1,4 millones de pacientes mayores de 65 años en los sistemas de salud de la Universidad de California, el equipo comprobó que cinco de estos fármacos estaban asociados con un menor riesgo de desarrollar alzhéimer.
Un equipo de UCSF y Gladstone Institutes ha descubierto una combinación de fármacos oncológicos que logra tratar con éxito un modelo animal de alzhéimer avanzado. De izquierda a derecha: Marina Sirota, Yaqiao Li y Yadong Huang. Foto: Michael Short / Gladstone Institutes.
De 1.300 a solo dos candidatos
«Gracias a todas estas fuentes de datos existentes, pasamos de 1.300 medicamentos, a 86, a diez y finalmente a solo cinco — resume Yaqiao Li, doctor en Biomedicina y autor principal del estudio. Y continúa—: En particular, los datos ricos recopilados por todos los centros de salud de la Universidad de California nos señalaron directamente los medicamentos más prometedores. Fue como una especie de ensayo clínico simulado”.
De esos cinco candidatos, el equipo de investigación seleccionó dos para su validación en el laboratorio. Ambos son conocidos fármacos contra el cáncer:
✅ Letrozole: un inhibidor de la aromatasa usado en el cáncer de mama en mujeres posmenopáusicas. Actúa sobre neuronas.
✅ Irinotecán: un inhibidor de la topoisomerasa usado contra los cánceres colorrectal, pancreático y pulmonar. Afecta positivamente a células gliales.
En este nuevo enfoque, el papel de estos dos medicamentos sería muy distinto: restaurar la salud celular del cerebro dañado por el Alzheimer.
«Elegimos letrozole porque actúa sobre neuronas, e irinotecán porque tiene efectos sobre las células gliales —explica el doctor Yadong Huang, director del Centro de Avance Traslacional en Gladstone y profesor de Neurología en la UCSF. Y añade—: El alzhéimer no afecta solo a las neuronas. También implica una disfunción profunda en las células gliales, que son esenciales para mantener el equilibrio del cerebro».
¿Qué efectos tuvo la combinación en modelos animales?
Para poner a prueba la hipótesis, los investigadores usaron un modelo murino de alzhéimer particularmente agresivo, con mutaciones que reproducen los rasgos más devastadores de la enfermedad humana: acumulación de placas de beta amiloide y de ovillos de proteína tau, así como pérdida neuronal y alteraciones del comportamiento.
Los ratones fueron divididos en grupos y tratados durante tres meses con letrozole, irinotecán, ambos fármacos combinados o un placebo. Aunque los tratamientos individuales ofrecieron mejoras parciales, solo la combinación logró revertir de forma integral la mayoría de los síntomas. Los animales tratados recuperaron memoria, mejoraron su capacidad de orientación espacial y mostraron una reducción significativa en los marcadores patológicos típicos del alzhéimer.
A nivel celular, el tratamiento combinado revirtió cientos de genes que estaban alterados por la enfermedad, y restableció patrones normales en neuronas y glías. También se observaron mejoras en rutas moleculares relacionadas con la sinapsis, la plasticidad cerebral y el metabolismo energético, imprescindibles para un funcionamiento cerebral saludable.
«Es muy emocionante ver cómo los datos computacionales se validan en un modelo animal ampliamente utilizado para el alzhéimer —afirma Huang—. Esperamos avanzar pronto hacia un ensayo clínico con pacientes humanos».
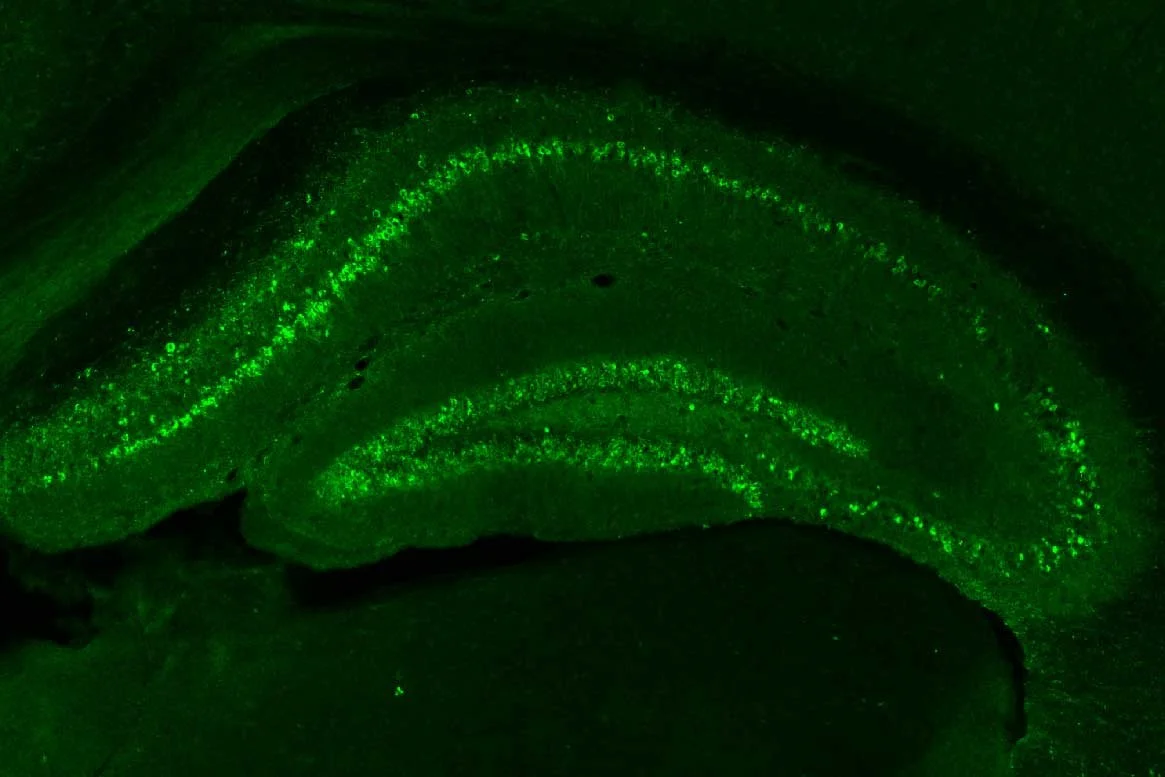
En ratones diseñados para modelar la enfermedad de Alzheimer, una proteína llamada tau (verde) se aglutina en el cerebro, como se en la imagen principal. Tras el tratamiento con letrozole y irinotecán, la mancha verde prácticamente desapareció. Cortesía: Li et al., Cell
Una terapia con ventajas únicas
Uno de los puntos fuertes de este descubrimiento es que se trata de medicamentos ya aprobados por la FDA, con perfiles de seguridad bien conocidos. Eso podría acelerar enormemente su paso a ensayos clínicos en humanos, saltándose fases preliminares que suelen consumir años y grandes sumas de dinero.
Además, los investigadores comprobaron que tanto el letrozole como el irinotecán pueden atravesar la barrera hematoencefálica, una frontera biológica que impide que muchas sustancias lleguen al cerebro. Este es un requisito indispensable para que un tratamiento tenga efecto en las enfermedades neurológicas.
Otro hallazgo notable fue el análisis de los registros médicos: personas que habían recibido estos fármacos por razones oncológicas tenían un riesgo significativamente menor de desarrollar la enfermedad de Alzheimer. Este tipo de evidencia, conocida como datos del mundo real, se está volviendo cada vez más relevante para priorizar tratamientos con mayor probabilidad de éxito.
Camino hacia la medicina personalizada
«El alzhéimer probablemente es el resultado de muchas alteraciones en genes y proteínas que, en conjunto, trastocan la salud cerebral —señala Huang—. Eso lo hace muy difícil de tratar con los enfoques tradicionales, que intentan atacar solo una molécula o una proteína».
Este estudio propone lo contrario: abordar la complejidad con soluciones igualmente complejas pero específicas, apuntando a redes celulares disfuncionales mediante una combinación racional de medicamentos.
«Si datos completamente independientes, como son la expresión génica y los registros clínicos, nos llevan a los mismos caminos y a los mismos medicamentos, y luego vemos que resuelven el alzheimer en un modelo genético, entonces tal vez estemos en el camino correcto —comenta Sirota. Y añade—: Somos optimistas en que esta terapia pueda traducirse rápidamente en una solución real para millones de pacientes».
¿Una nueva era en el tratamiento de la demencia?
El estudio no está exento de limitaciones. Los investigadores reconocen que los datos farmacológicos se basaron en estudios con líneas celulares cancerosas, y que los modelos animales no replican al 100% la biología humana.
También se observaron diferencias de respuesta entre sexos, con mayores beneficios conductuales en ratones machos que en hembras, lo que sugiere que los efectos hormonales también podrían influir en la eficacia de la terapia.
Aun así, el avance representa una nueva forma de pensar los tratamientos para enfermedades complejas. No se trata solo de desarrollar nuevas moléculas, sino de usar de manera inteligente lo que ya existe, combinando ciencia de datos, biología celular y evidencia clínica para diseñar estrategias terapéuticas más efectivas y personalizadas. ▪️
Información facilitada por la Universidad de California en San Francisco
Fuente: Li, Yaqiao et al. Cell-type-directed network-correcting combination therapy for Alzheimer’s disease. Cell (2025). DOI: 10.1016/j.cell.2025.06.035