El latido invisible del cerebro: así detectan los científicos alteraciones vasculares que aceleran el deterioro cognitivo
Un nuevo método de neuroimagen permite observar cómo laten los microvasos del cerebro con cada pulso cardíaco. El hallazgo saca a la luz alteraciones ocultas del envejecimiento que podrían explicar el avance del alzhéimer y otras demencias.
Por Enrique Coperías
Un equipo de la Universidad del Sur de California (USC) ha desarrollado un método pionero para cartografiar la pulsatilidad volumétrica microvascular en humanos vivos. De este modo han logrando medir cómo se expanden y contraen los diminutos vasos del cerebro con cada latido cardíaco. Crédito: Imagen conceptual generada con DALL-E
Durante décadas, los científicos han sabido que el corazón no es el único motor de la vida que late en nuestro interior. Cada contracción cardíaca lanza una onda de presión que recorre las arterias y se transmite hasta las profundidades del cerebro.
Ese pulso encefálico invisible, apenas perceptible incluso con la tecnología de imagen más sofisticada, desempeña un papel esencial, ya que impulsa la circulación de fluidos, facilita la limpieza de desechos y mantiene en equilibrio el delicado ecosistema neuronal.
Sin embargo, hasta ahora, observar con nitidez ese latido cerebral en los diminutos vasos sanguíneos del cerebro había sido prácticamente imposible. Solo se podía medir en grandes arterias, con técnicas como la ecografía Doppler transcraneal y la resonancia magnética de contraste de fase. Pero lo que ocurre en las redes microscópicas de arteriolas y capilares —las que verdaderamente sostienen la vida de las neuronas— seguía siendo un territorio oscuro.
Cambios cerebrales inesperados ligados al envejecimiento
Un equipo de investigadores de la Universidad del Sur de California (USC), en Estados Unidos, acaba de abrir esa ventana. En un trabajo publicado en la revista Nature Cardiovascular Research, un equipo de científicos, con Danny J. J. Wang al frente, presentan un método pionero para cartografiar la pulsatilidad volumétrica microvascular en seres humanos vivos.
Dicho de otro modo: han logrado medir cómo se expanden y contraen los minúsculos vasos del cerebro con cada latido. Y lo han hecho con una resolución nunca antes alcanzada, capaz de discriminar diferencias entre capas corticales o entre la sustancia gris y la sustancia blanca. Recordemos que la primera está formada sobre todo por cuerpos de neuronas, y es donde se procesan y generan las señales del cerebro; y que la sustancia blanca aparece compuesta principalmente por axones recubiertos de mielina, y actúa como las autopistas que conectan distintas zonas del cerebro y permiten que la información viaje rápido.
El hallazgo no es solo un avance técnico: también revela cambios cerebrales inesperados ligados al envejecimiento. Los investigadores comprobaron que, en las personas mayores, la pulsación microvascular se intensifica en regiones profundas de la sustancia blanca. Esa alteración, que pasa inadvertida en exploraciones convencionales, podría estar relacionada con el deterioro cognitivo, la hipertensión y enfermedades neurodegenerativas como el alzhéimer.
El sistema glinfático y el pulso cerebral
La idea de que las arterias no son simples tubos de transporte,sino auténticas bombas secundarias, no es nueva. Hace apenas una década, un grupo de neurocientíficos describió el llamado sistema glinfático, un mecanismo de depuración cerebral en el que el líquido cefalorraquídeo penetra en el cerebro a través de los espacios perivasculares. Como un sistema de alcantarillado biológico, este flujo arrastra metabolitos y proteínas tóxicas, entre ellas la famosa beta-amiloide vinculada a la enfermedad de Alzheimer.
El motor de ese sistema, según se demostró en ratones, es precisamente la pulsación arterial. Cada vez que una arteria se dilata y se contrae, empuja el fluido hacia el interior del tejido. Si el pulso pierde fuerza o se altera, la limpieza cerebral se ralentiza y los residuos se acumulan. De ahí que una pulsación excesiva, como ocurre con la hipertensión arterial, o insuficiente, como sucede en la edad avanzada, pueda desregular el equilibrio y favorecer patologías neurológicas.
El problema era que todos esos descubrimientos se habían realizado con técnicas invasivas en modelos animales. En humanos, los investigadores apenas podían inferir la pulsación en arterias grandes, lejos de los capilares cerebrales donde realmente se produce el intercambio metabólico.
«La pulsación arterial es como la bomba natural del cerebro, ayuda a mover los fluidos y a eliminar los desechos —resume Wang, profesor de Neurología y Radiología en la Keck School of Medicine y autor sénior del trabajo. Y añade—: Nuestro nuevo método nos permite ver, por primera vez en personas, cómo cambian los volúmenes de esos diminutos vasos sanguíneos con el envejecimiento y los factores de riesgo vascular. Esto abre nuevas vías para estudiar la salud cerebral, la demencia y la enfermedad de pequeños vasos».
Wang y su equipo presentan una innovadora técnica de resonancia magnética a 7 Teslas que permite, por primera vez, mapear de forma diferenciada la pulsatilidad microvascular en las capas corticales y en la sustancia blanca del cerebro. Costesía: Stevens INI
Un escáner 7 Teslas como lupa
El equipo dirigido por Wang ha resuelto ese reto combinando varias tecnologías de resonancia magnética avanzada. Utilizaron un escáner 7 Teslas, mucho más potente que los aparatos clínicos habituales, y dos secuencias específicas: la VASO (ocupación del espacio vascular), sensible a los cambios en el volumen sanguíneo; y la ASL (etiquetado de spin arterial), que mide el flujo sanguíneo cerebral. Además, registraron de manera simultánea el pulso cardíaco de los participantes para sincronizar las imágenes con las fases del ciclo.
El resultado es un mapa cerebral en cuatro dimensiones —espacio y tiempo— que permite reconstruir cómo varía el volumen de los vasos en cada capa del cerebro con cada latido. A esa medida la han bautizado como índice de pulsatilidad microvascular volumétrica (mvPI).
Los ensayos se realizaron en un grupo de veintitrés voluntarios sanos: once jóvenes, con una media de veintiocho años; y doce adultos mayores en torno a los sesenta años El análisis confirmó algo esperado: la pulsación cerebral es más intensa en la superficie cortical, donde las arterias piales —los vasos sanguíneos que recorren la superficie del cerebro, sobre la pía madre (la membrana más interna de las meninges)— reciben de lleno la onda de presión, y se atenúa progresivamente al penetrar en las capas profundas.
Pero también desveló un fenómeno sorprendente: en la sustancia blanca de las personas mayores, el mvPI era significativamente más alto que en los jóvenes.
«Estos hallazgos proporcionan un eslabón perdido entre lo que vemos en la imagen de los grandes vasos y el daño microvascular que observamos en el envejecimiento y la enfermedad de Alzheimer», explica Fanhua Guo, autor principal del estudio y posdoctorado en el laboratorio de Wang.
Envejecimiento y cambios vasculares ocultos
Pero ¿por qué aumenta la pulsación cerebral en esas zonas profundas con la edad? Los autores sugieren varias explicaciones. Con los años, los vasos sanguíneos pierden elasticidad, las paredes se engrosan con depósitos de colágeno y la densidad capilar disminuye. Todo ello reduce la capacidad de amortiguar la onda de presión que llega desde las arterias grandes. El resultado es que la energía del latido se transmite más lejos de lo que debería, hasta las delicadas arteriolas de la sustancia blanca.
Este fenómeno podría tener consecuencias directas. El exceso de pulsación mecánica dañaría progresivamente la microvasculatura cerebral, favoreciendo de este modo la aparición de lesiones de sustancia blanca, esas manchas hiperintensas que se observan en las resonancias magnéticas de ancianos y que se asocian al deterioro cognitivo, a caídas y a un mayor riesgo de demencia.
Además, un pulso anómalo puede descoordinarse con el flujo glinfático, lo que dificulta la limpieza de residuos cerebrales y crea un círculo vicioso de acumulación tóxica.
Los investigadores constataron también que el efecto era más marcado en las personas mayores con hipertensión arterial, lo que apunta a una interacción entre envejecimiento vascular y presión arterial elevada. Aunque el estudio es preliminar y con un número reducido de participantes, la señal es clara: el mvPI ofrece un nuevo biomarcador cerebral para detectar alteraciones vasculares antes de que se traduzcan en síntomas clínicos.
Fiabilidad del nuevo método
Un avance técnico de esta magnitud siempre despierta la pregunta obvia: ¿y si todo fuera un artefacto del escáner? Para disipar dudas, Wang y su equipo sometieron su método a varias pruebas de fiabilidad. Escanearon repetidamente a algunos voluntarios con meses de diferencia y comprobaron que los patrones individuales se mantenían estables en cada persona, aunque diferentes entre sujetos.
Además, realizaron simulaciones para descartar que el ruido de la señal, la respiración o el volumen de tejido analizado distorsionaran los resultados. Incluso compararon sus medidas con las obtenidas en las arterias grandes mediante otra técnica de resonancia (4D-flow), encontrando correlaciones significativas. Todo ello refuerza la idea de que el mvPI refleja de verdad un fenómeno fisiológico y no un espejismo estadístico.
«Poder medir estos diminutos pulsos vasculares in vivo es un paso crítico hacia adelante — subraya Arthur W. Toga, director del Stevens Neuroimaging and Informatics Institute (INI). Y continúa—: Esta tecnología no solo amplía nuestra comprensión del envejecimiento cerebral, sino que también tiene un gran potencial para el diagnóstico temprano y el seguimiento de los trastornos neurodegenerativos».
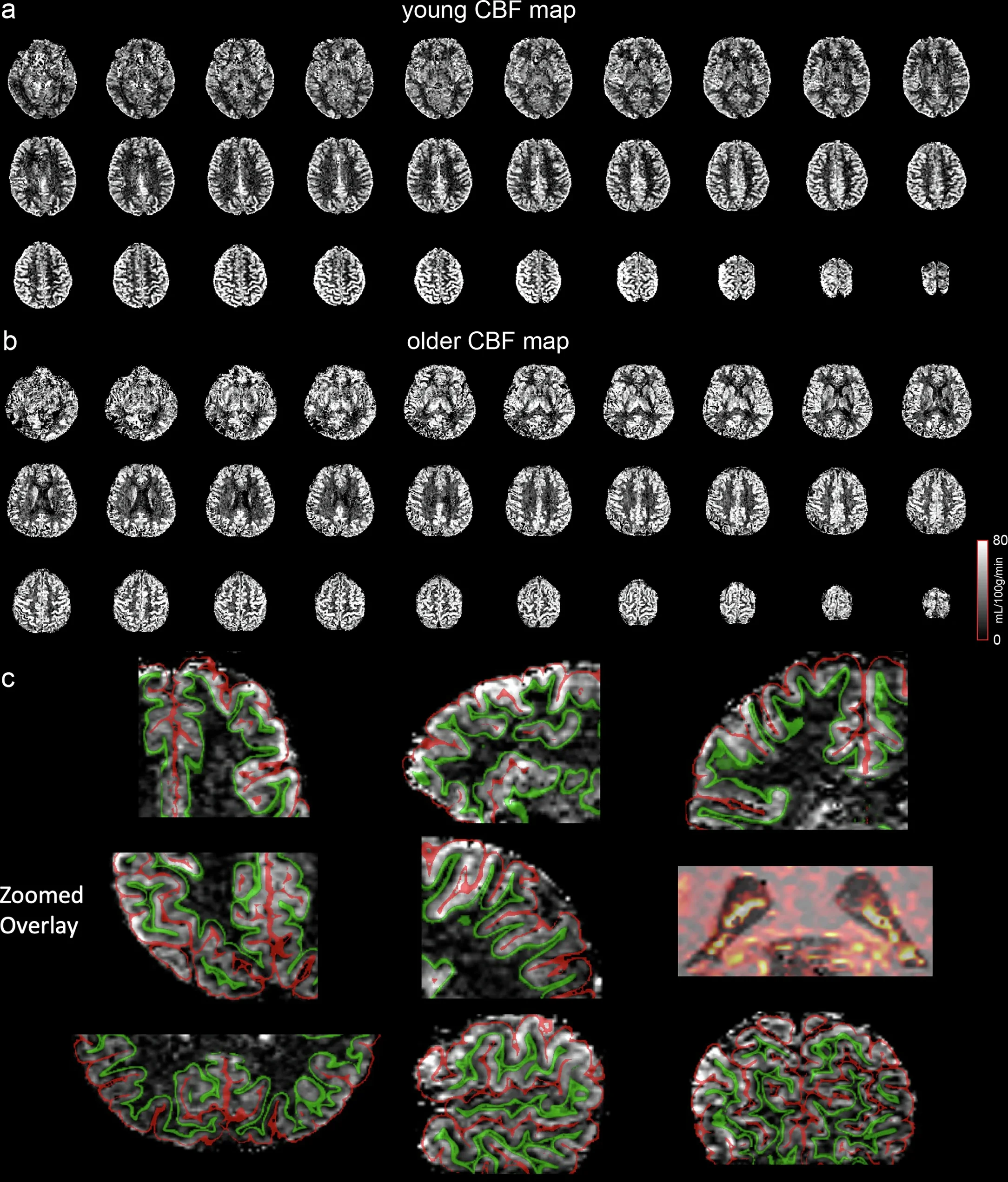
Mapas de flujo sanguíneo cerebral (CBF) obtenidos con resonancia magnética de alta resolución. (a) Participante joven. (b) Participante mayor. (c) Ampliaciones con superposición de segmentación. La calidad y especificidad espacial de estas imágenes permiten un análisis detallado por capas corticales y una visualización precisa del plexo coroideo, donde se observa una alta distribución del flujo sanguíneo. Cortesía: Guo, F., Zhao, C., Shou, Q. et al.
Una lupa sobre el futuro de la neurología
La posibilidad de medir la pulsación microvascular in vivo abre un abanico de aplicaciones:
✅ En primer lugar, ofrece una ventana privilegiada para estudiar cómo cambia el cerebro con la edad y por qué unas personas desarrollan demencia y otras no.
✅ También puede servir para evaluar el impacto de factores de riesgo vascular, como la hipertensión, la diabetes y el colesterol elevado, mucho antes de que aparezcan lesiones visibles en resonancia magnética.
✅ En el terreno de las enfermedades neurodegenerativas, la técnica podría ayudar a desentrañar cómo interactúan los fallos vasculares con la acumulación de proteínas tóxicas. Si la limpieza glinfática depende del pulso arterial, cualquier alteración puede ser la chispa que acelere la cascada patológica del alzhéimer o la enfermedad de Parkinson.
Desde el punto de vista clínico, aún queda un largo camino por recorrer. El procedimiento requiere largos tiempos de escaneo y equipos de resonancia magnética de 7 Teslas, hoy reservados a investigación. Pero los autores creen que, ajustando la resolución y combinando secuencias, sería posible trasladarlo a resonancias de 3 Teslas, más comunes en hospitales.
Un latido que cuenta historias
El estudio también ofrece un relato más amplio sobre cómo late nuestro cerebro. Los mapas obtenidos muestran que la pulsación cerebral no es uniforme: varía según territorios vasculares, con diferencias entre arterias anteriores, medias y posteriores. Incluso se observan asimetrías, como una mayor vulnerabilidad del lóbulo frontal derecho en personas mayores, algo que coincide con estudios previos sobre el declive del flujo sanguíneo cerebral en esa región.
En el fondo, lo que emerge es la idea de que el envejecimiento cerebral no solo deteriora las neuronas, sino también la maquinaria invisible que las sostiene: los vasos sanguíneos cerebrales que las nutren y los latidos vasculares que las limpian.
Ver esos cambios en vivo, antes de que el daño sea irreversible, abre la posibilidad de intervenir a tiempo.
Como todo hallazgo, este es apenas un primer paso. La muestra de voluntarios es pequeña y homogénea; harán falta cohortes más grandes con diversidad étnica y clínica, para validar el mvPI como biomarcador cerebral, advierte Wang. También será necesario comprobar si los cambios detectados predicen realmente el deterioro cognitivo o la aparición de demencia.
Pero la promesa es poderosa. «Esto es solo el comienzo —afirma Wang—. Nuestro objetivo es llevarlo de los laboratorios de investigación a la práctica clínica, donde podría guiar estrategias de diagnóstico, prevención y tratamiento para millones de personas en riesgo de demencia». ▪️
Información facilitada por la Keck School of Medicine of USC
Fuente: Guo, F., Zhao, C., Shou, Q. et al. Assessing cerebral microvascular volumetric with high-resolution 4D cerebral blood volume MRI at 7 T. Nature Cardiovascular Research (2025). DOI: https://doi.org/10.1038/s44161-025-00722-1
Preguntas & Respuestas: Pulso cerebral
🧠 ¿Qué es la pulsatilidad microvascular cerebral?
Es la expansión y contracción rítmica de los vasos sanguíneos más pequeños del cerebro con cada latido del corazón.
🧠 ¿Por qué es importante estudiar la microvasculatura en el envejecimiento cerebral?
Porque cambios en la microvasculatura pueden afectar la limpieza de desechos del cerebro, favorecer la acumulación de beta-amiloide y contribuir a enfermedades como el alzhéimer.
🧠 ¿Qué tecnología se ha usado en este estudio?
Resonancia magnética de 7 Teslas, con las técnicas VASO y ASL.
🧠 ¿Qué aplicaciones clínicas puede tener?
Podría servir para detectar riesgo de demencia, evaluar salud vascular en personas mayores e incluso guiar tratamientos de prevención.