Una nueva herramienta permite predecir cómo evoluciona el cáncer y esquiva los tratamientos
Los tumores no cambian al azar: siguen reglas evolutivas que determinan cómo crecen y por qué acaban resistiendo a los tratamientos. Un nuevo modelo desarrollado en Estados Unidos permite anticipar esos cambios a partir de la arquitectura cromosómica de las células cancerosas.
Por Enrique Coperías, periodista científico
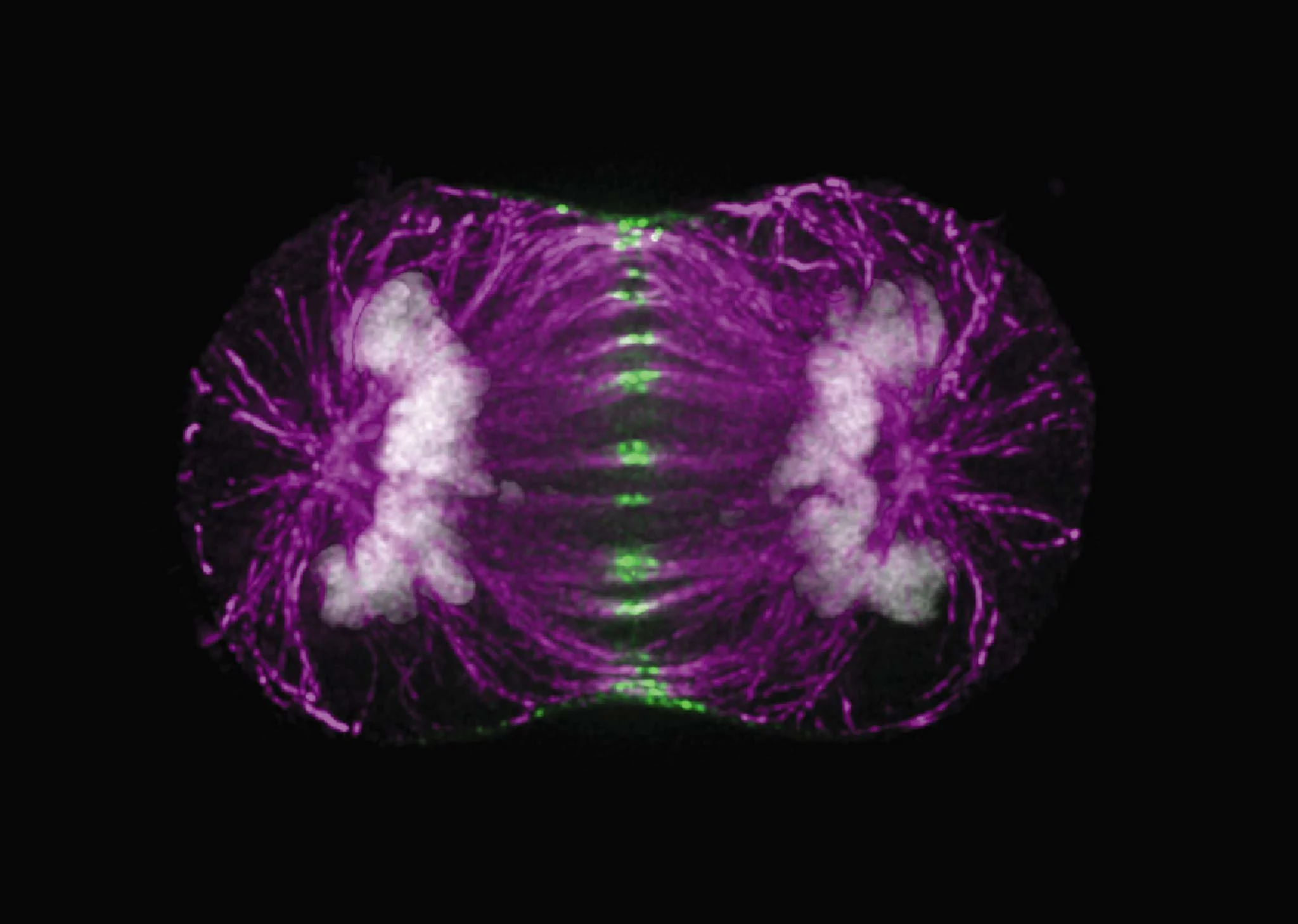
División de una célula cancerosa durante la mitosis. La imagen muestra la separación del material genético, un proceso en el que pueden producirse errores en el reparto de los cromosomas que favorecen la evolución del tumor y su resistencia a los tratamientos. Cortesía: Dr. Paul D. Andrews / University of Dundee n/ Division of Gene Regulation and Expression / https://www.nikonsmallworld.com/
El cáncer no avanza en línea recta. Se transforma, se adapta y, a menudo, aprende a esquivar los tratamientos que se le lanzan encima. Una de las claves de esa capacidad de adaptación está en su genoma, y en particular en un fenómeno tan común como desconcertante: la aneuploidía, es decir, la ganancia o pérdida de cromosomas completos.
Ahora, un equipo del Moffitt Cancer Center, en Estados Unidos, ha desarrollado una nueva herramienta matemática capaz de cartografiar ese terreno genético cambiante y anticipar hacia dónde puede evolucionar un tumor. El trabajo, publicado en la revista Nature Communications, propone una forma inédita de predecir la trayectoria evolutiva del cáncer y su posible resistencia a los tratamientos.
«El cáncer evoluciona constantemente. A medida que los tumores crecen, sus células cometen errores al copiar y repartir su ADN, y muchos de esos errores implican ganar o perder cromosomas completos —explica Noemi Andor, investigadora del Moffitt Cancer Center y autora principal del estudio. Y añade—: Eso genera, dentro de un mismo tumor, una mezcla de células cancerosas con combinaciones cromosómicas distintas».
Aneuploidía: cuando ganar o perder cromosomas impulsa al tumor
La mayoría de los tumores sólidos humanos —hasta el 90%— presentan aneuploidía. A diferencia de las mutaciones puntuales, que afectan a genes individuales, estos cambios alteran de golpe el número de copias de cientos o miles de genes. El impacto es profundo: se modifican los niveles de ARN, la producción de proteínas y el funcionamiento global de la célula.
Durante años, los científicos han observado patrones recurrentes de ganancia o pérdida de cromosomas completos en distintos tipos de cáncer, pero entender por qué ciertos cambios cromosómicos prosperan y otros no ha sido una tarea ardua.
🗣️ «El gran problema es que hasta ahora no teníamos una forma fiable de saber cuáles de esas combinaciones ayudan realmente a las células cancerosas a sobrevivir —comenta Andor—. El número de estados posibles es enorme, y la mayoría de los métodos solo ofrecen fotografías estáticas o promedios que ocultan la dinámica real».
Por qué la evolución del cáncer ha sido tan difícil de predecir
La razón de esta dificultad es doble:
✅ Por un lado, la aneuploidía suele ser perjudicial para las células: desequilibra los sistemas internos y activa mecanismos de control celular que pueden frenar la división celular o provocar la muerte celular.
✅ Por otro, en determinadas circunstancias —bajo estrés, en ambientes hostiles o frente a fármacos— esos mismos cambios pueden conferir ventajas adaptativas. El resultado es una tensión constante entre costes y beneficios que da forma a la evolución tumoral.
Hasta ahora, los modelos teóricos del cáncer habían simplificado ese proceso. Algunos asumían que todos los cambios cromosómicos eran equivalentes; otros los vinculaban al número de oncogenes o genes supresores de tumores presentes en cada cromosoma. Pero la realidad es mucho más compleja: el efecto de ganar o perder un cromosoma depende del contexto genético previo de la célula, del entorno tumoral en el que crece el tumor y de las presiones externas, como la quimioterapia.
«Un aspecto clave es que el efecto de un cambio cromosómico depende del contexto —explica Andor en un comunicado del Moffitt Cancer Center & Research Institute. Y continúa—: La misma ganancia o pérdida puede ser beneficiosa en una célula y perjudicial en otra, según su configuración cromosómica previa. Esa dependencia del contexto ayuda a entender por qué la evolución del cáncer ha sido tan difícil de predecir durante décadas».
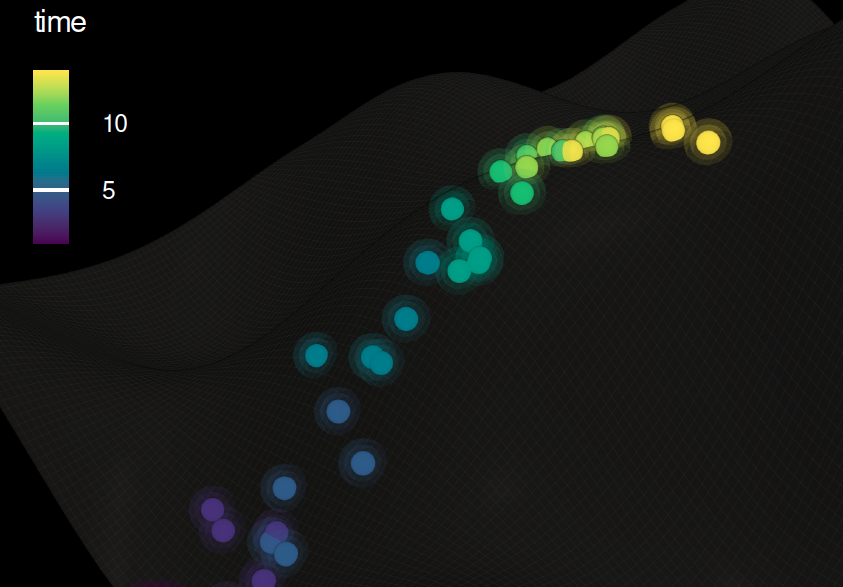
Representación conceptual de la evolución cromosómica del cáncer. Cada punto corresponde a una configuración cromosómica distinta de una célula tumoral, situada en un paisaje de aptitud que indica qué variantes genéticas favorecen su supervivencia a lo largo del tiempo. Cortesía: Moffitt Cancer Center
ALFA-K: un mapa para seguir los pasos del cáncer en tiempo real
El nuevo método desarrollado en Moffitt, bautizado como ALFA-K, intenta capturar esa complejidad. Su nombre completo —Adaptive Local Fitness Landscapes for Aneuploid Karyotypes— da una pista de su ambición: reconstruir paisajes de aptitud genética que describen qué configuraciones cromosómicas permiten a las células crecer mejor y cuáles las penalizan.
Recordemos que la aptitud genética es la capacidad de una célula u organismo para sobrevivir, reproducirse y dejar descendencia en un entorno concreto.
«ALFA-K se desarrolló precisamente para resolver ese vacío —señala Andor—. Utiliza datos longitudinales de células individuales para reconstruir cómo las células cancerosas se mueven entre distintos estados cromosómicos a lo largo del tiempo y cuáles de ellos favorece la selección natural».
Paisajes de aptitud genética y selección natural en los tumores
La idea central procede de la biología evolutiva. En un paisaje de aptitud, cada punto representa un estado genético posible y su altura indica la capacidad de la célula para sobrevivir y proliferar. Los tumores no se mueven al azar por ese paisaje: tienden a ascender hacia picos de mayor aptitud.
El problema es que, en el caso del cáncer, el número de combinaciones cromosómicas posibles es astronómico, muy superior a cualquier cosa que pueda mapearse de forma exhaustiva.
ALFA-K aborda ese reto centrándose solo en regiones locales del paisaje, aquellas que el tumor explora realmente a lo largo del tiempo. Para ello, el equipo utilizó datos longitudinales de secuenciación de células individuales: muestras tomadas en distintos momentos de la evolución tumoral, tanto en cultivos celulares como en tumores implantados en ratones. A partir de cómo cambian las frecuencias de distintos cariotipos —la combinación concreta de cromosomas— el modelo infiere su aptitud relativa y extrapola el efecto de modificaciones cercanas, como la ganancia o pérdida de un cromosoma adicional.
Cómo los cambios cromosómicos permiten grandes saltos evolutivos
El resultado es un mapa dinámico capaz no solo de describir el pasado evolutivo del tumor, sino también de anticipar su futuro inmediato. En las pruebas realizadas, ALFA-K fue capaz de predecir con notable precisión qué configuraciones cromosómicas emergían en etapas posteriores, incluso cuando esas combinaciones no se habían observado previamente.
🗣️ «Sin esta información, la progresión del cáncer y la resistencia a los tratamientos parecen impredecibles —subraya Andor—. Nuestro trabajo demuestra que no lo son: siguen reglas medibles».
Una de las conclusiones más llamativas del estudio tiene que ver con la duplicación completa del genoma, un evento frecuente en cáncer conocido como duplicación del genoma completo. Cuando una célula multiplica por dos todos sus cromosomas, pasa a tener el doble de material genético, lo que durante mucho tiempo se consideró un estado inestable y peligroso. Sin embargo, el análisis revela que estas células toleran mejor posteriores alteraciones cromosómicas.
La duplicación completa del genoma y la tolerancia al caos genético
«Sabíamos que la duplicación completa del genoma podía ayudar a las células cancerosas a sobrevivir, pero no teníamos forma de medir cuánto las protege realmente», explica Andor. «ALFA-K permite cuantificar ese efecto amortiguador».
En términos evolutivos, la duplicación del genoma suaviza el paisaje de aptitud: reduce la proporción de cambios claramente perjudiciales y facilita la exploración de nuevas configuraciones genéticas.
«Esa protección no es absoluta —matiza la investigadora. Y añade—: Existe un umbral evolutivo a partir del cual la duplicación del genoma se vuelve ventajosa, y ahora podemos medirlo. Deja de ser una observación descriptiva para convertirse en un evento evolutivo predecible».
Las células cancerosas no solo acumulan mutaciones: recorren un mapa evolutivo marcado por ganancias y pérdidas de cromosomas que determinan qué células sobreviven. Un nuevo modelo permite seguir ese trayecto y anticipar sus próximos movimientos. Cortesía: UCSF
El papel del entorno y la quimioterapia en la resistencia tumoral
El entorno tumoral también importa, y mucho. El equipo observó que los tumores que proliferan en organismos vivos —no en placas de laboratorio— presentan paisajes de aptitud más abruptos: los cambios cromosómicos tienen efectos más extremos, tanto positivos como negativos. Algo similar ocurre cuando las células se exponen a cisplatino, un fármaco de quimioterapia ampliamente utilizado.
🗣️ «Cuando la quimioterapia aumenta la mala segregación de cromosomas, las células se mueven más rápido por estos paisajes evolutivos —advierte Andor—. Dependiendo de la forma del paisaje, ese desplazamiento puede empujar al tumor hacia estados cromosómicos más tolerantes a la inestabilidad».
Este hallazgo refuerza una idea cada vez más aceptada en oncología: los tratamientos no solo eliminan células tumorales, sino que también remodelan el paisaje evolutivo del cáncer, lo que favorece rutas de escape que pueden conducir a la recaída.
Otra aportación importante del trabajo es mostrar que no existe un efecto universal de los cambios cromosómicos. El impacto de perder o ganar un cromosoma depende del cariotipo de partida. Dos células con configuraciones ligeramente distintas pueden reaccionar de forma opuesta al mismo cambio. Esto ayuda a explicar por qué ciertos marcadores genéticos solo adquieren valor pronóstico cuando se consideran en combinación con otros, y no de manera aislada.
Hacia una oncología que se anticipe a la evolución del tumor
El modelo también permite explorar cómo la tasa de errores en la segregación cromosómica influye en qué clones dominan el tumor. A tasas bajas de error, suelen imponerse las configuraciones más aptas. Pero cuando los errores son frecuentes, esas configuraciones pueden perder su ventaja frente a clones más robustos, aunque menos eficientes.
La implicación clínica es clara. «ALFA-K desplaza la investigación del cáncer desde la descripción de lo que vemos hacia la predicción de cómo va a cambiar—resume Andor. Y pronostica—: En el futuro, este enfoque podría ayudar a interpretar biopsias repetidas, detectar cuándo un tumor se acerca a una transición evolutiva peligrosa y elegir tratamientos que limiten su capacidad de explorar configuraciones cromosómicas dañinas».
Si esta ambición se confirma en estudios clínicos futuros, la oncología podría ganar una herramienta poderosa para anticiparse al cáncer, en lugar de limitarse a reaccionar cuando ya ha cambiado de forma. «El objetivo a largo plazo es una oncología consciente de la evolución —dice la investigadora. Y concluye—: Anticiparse a los cambios del tumor, en lugar de reaccionar cuando la resistencia ya ha aparecido».▪️
Información facilitada por el Moffitt Cancer Center & Research Institute
Fuente: Beck, R.J., Li, T. & Ando. N. ALFA-K: Local adaptive mapping of karyotype fitness landscapes. Nature Communications (2025). DOI: https://doi.org/10.1038/s41467-025-67750-0