La resurrección de una enzima de hace 2.300 millones de años ofrece pistas sobre la Tierra primitiva y la búsqueda de vida extraterrestre
Antes de que el oxígeno transformara el planeta y la vida se volviera compleja, unos microbios primitivos aprendieron a extraer del aire un nutriente esencial. Hoy, al resucitar la enzima que lo hizo posible, la ciencia empieza a leer con más claridad los primeros capítulos de la historia de la Tierra… y quizá también los de otros mundos.
Por Enrique Coperías, periodista científico
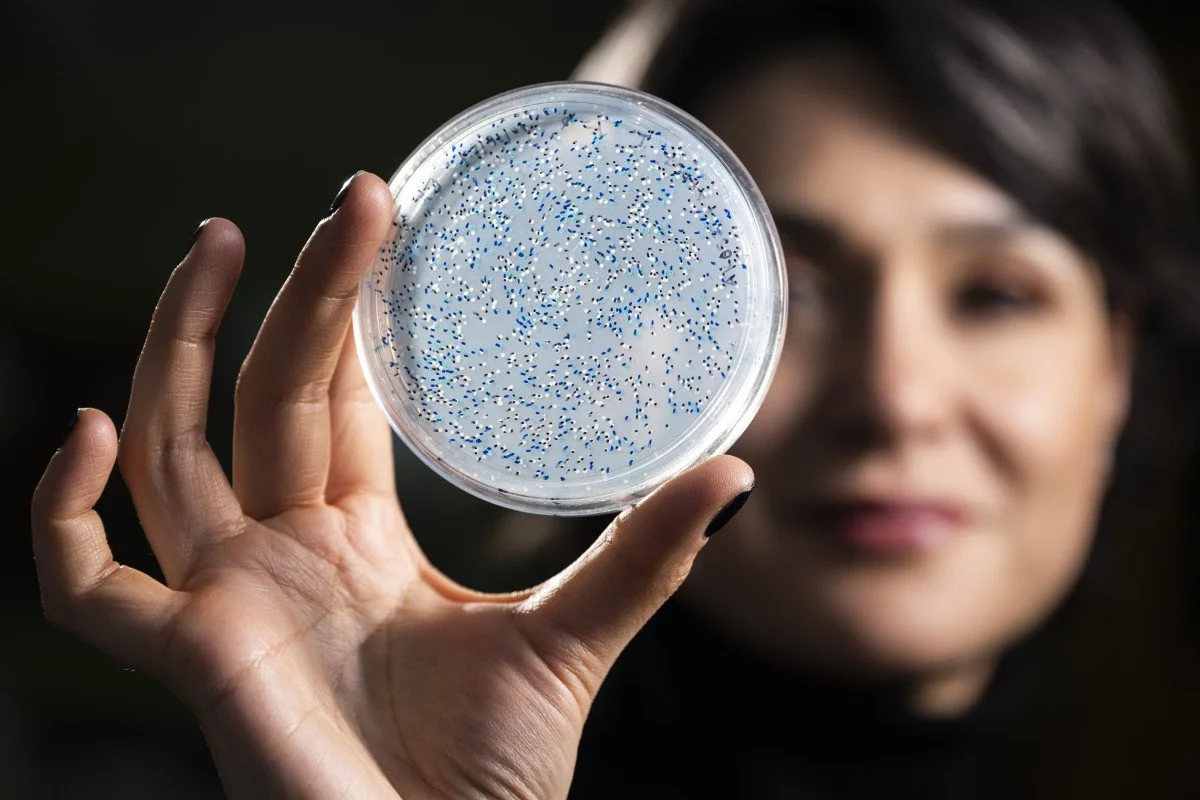
Betül Kaçar, profesora asociada de Bacteriología en la Universidad de Wisconsin–Madison, sostiene una placa de Petri con microbios capaces de fijar nitrógeno. Es una de las pioneras de la paleobiología molecular, una disciplina que reconstruye moléculas del pasado profundo de la vida.
Foto: Jeff Miller / UW–Madison
La Tierra primitiva es un territorio casi inaccesible para la ciencia. No quedan fósiles claros de sus primeros habitantes, ni restos directos de los metabolismos que sostuvieron la vida hace más de tres mil millones de años.
En ese paisaje borroso, los investigadores han aprendido a leer huellas indirectas: pequeñas desviaciones en la composición química de las rocas que funcionan como firmas de procesos biológicos. Entre todas ellas, el nitrógeno ocupa un lugar especial. Y ahora, gracias a una enzima resucitada en el laboratorio, esa señal se ha vuelto mucho más fiable.
«Elegimos una enzima que realmente marcó el rumbo de la vida en este planeta y luego examinamos su historia. Sin la nitrogenasa, no existiría la vida tal y como la conocemos», explica Betül Kaçar, profesora de Bacteriología en la Universidad de Wisconsin–Madison y directora del estudio.
La nitrogenasa, la enzima que hizo posible la vida
Un equipo internacional de científicos ha reconstruido versiones ancestrales de la nitrogenasa, la enzima responsable de transformar el nitrógeno atmosférico —un gas abundante pero químicamente inerte— en amonio, una forma utilizable por los seres vivos.
El resultado es sorprendente: estas enzimas antiguas, que representan estados evolutivos de hace hasta 2.300 millones de años, producen prácticamente la misma firma isotópica que las nitrogenasas modernas. La conclusión es contundente: la huella química del nitrógeno biológico ha sido extraordinariamente estable a lo largo de más de dos mil millones de años. Y eso tiene implicaciones profundas, no solo para entender la historia temprana de la Tierra, sino también para buscar vida en otros mundos.
La fijación biológica del nitrógeno es uno de los pilares de la biosfera. Sin ella, las proteínas, los ácidos nucleicos y, en última instancia, la vida tal y como la conocemos no serían posibles. A diferencia de otros ciclos biogeoquímicos, este proceso depende de una sola familia de enzimas: las nitrogenasas. Esa singularidad convierte al nitrógeno en un candidato ideal para rastrear la actividad biológica en el pasado remoto.
Genes «antiguos» creados desde cero e inoculados en bacterias modernas
El problema es que hasta ahora no estaba claro si las nitrogenasas actuales, moldeadas por miles de millones de años de evolución y por un planeta oxigenado, podían servir como modelo fiable para interpretar señales químicas en rocas formadas cuando la Tierra era radicalmente distinta.
🗣️ «Hace tres mil millones de años, la Tierra era un lugar radicalmente distinto al que conocemos hoy», recuerda Holly Rucker, doctoranda en el laboratorio de Kaçar y primera autora del trabajo.
Para resolver esa duda, los investigadores recurrieron a una estrategia audaz: la biología sintética aplicada al pasado profundo. A partir de análisis filogenéticos, reconstruyeron secuencias genéticas ancestrales de la nitrogenasa, estimadas en distintos momentos de la historia de la vida, desde unos 700 millones hasta más de 2.000 millones de años atrás.
Kaçar y sus colegas no se limitaron a modificar enzimas actuales, sino que sintetizaron genes completos desde cero, basándose en inferencias evolutivas. Después, introdujeron esos genes antiguos en una bacteria moderna, en concreto, la Azotobacter vinelandii, a la que se le había eliminado su propia nitrogenasa.
El equipo liderado por Betül Kaçar sintetizó genes ancestrales completos desde cero y los introdujo en una bacteria moderna, Azotobacter vinelandii, a la que se le había eliminado su propia nitrogenasa, para estudiar cómo funcionaban enzimas de hace miles de millones de años en células vivas.
Qué fue la Gran Oxidación
«Antes de la Gran Oxidación, la atmósfera contenía más dióxido de carbono y metano, y la vida consistía principalmente en microbios anaerobios —explica Rucker. Y añade—: Poder entender cómo estos microbios accedían a un nutriente tan vital como el nitrógeno ofrece una imagen mucho más precisa de cómo la vida persistió y evolucionó en el periodo anterior a que los organismos dependientes del oxígeno empezaran a transformar el planeta».
No hay que olvidar que la llamada Gran Oxidación fue uno de los grandes puntos de inflexión en la historia del planeta. Ocurrió hace aproximadamente 2.400 millones de años, cuando el oxígeno empezó a acumularse de forma permanente en la atmósfera terrestre. Hasta entonces, la Tierra había sido un mundo prácticamente sin oxígeno, dominado por microbios anaerobios.
La aparición y expansión de organismos capaces de realizar fotosíntesis oxigénica, tal vez cianobacterias, alteró de manera irreversible la química del aire, los océanos y las rocas. Este cambio desencadenó extinciones masivas de formas de vida adaptadas a ambientes anóxicos, pero también abrió el camino para la evolución de metabolismos más complejos y, mucho más tarde, para la vida multicelular.
Una firma química estable durante miles de millones de años
El experimento de Kaçar y sus colegas permitió algo inédito: observar cómo funcionaban, dentro de una célula viva, enzimas que ya no existen en la naturaleza. Aunque estas nitrogenasas ancestrales resultaron ser menos eficientes que la versión moderna —fijaban nitrógeno a un ritmo algo más lento—, todas fueron plenamente funcionales. Las bacterias crecieron, se alimentaron exclusivamente del nitrógeno atmosférico y dejaron en su biomasa una firma isotópica medible.
Ahí llegó la gran sorpresa. Las proporciones entre los isótopos estables del nitrógeno (14N y 15N) en la biomasa producida por las enzimas ancestrales se situaron en un rango muy estrecho, prácticamente indistinguible del que generan hoy las nitrogenasas modernas dependientes de molibdeno.
No hubo una tendencia clara asociada a la antigüedad de la enzima: la nitrogenasa más vieja no dejó una señal más primitiva ni más extrema. Todas coincidieron, grosso modo, en una fracción isotópica de entre menos uno y menos tres por mil respecto al nitrógeno atmosférico.
Durante años, gran parte de la interpretación del registro geológico se había apoyado en una suposición difícil de comprobar.
🗣️ «Gran parte de ese trabajo se basaba en la idea de que las enzimas antiguas producían las mismas firmas isotópicas que las versiones modernas —admite Rucker. Y continúa—: Yo empecé a preguntarme: ¿estamos interpretando realmente bien el registro geológico?».
La evidencia más antigua de fijación biológica del nitrógeno
Ese rango coincide de forma notable con los valores más bajos medidos en rocas sedimentarias de hasta 3.200 millones de años de antigüedad, consideradas desde hace tiempo como la evidencia más antigua de fijación biológica del nitrógeno. La nueva investigación refuerza así una hipótesis clave de la geobiología: que esas señales en las rocas reflejan realmente actividad biológica y no procesos abióticos o artefactos posteriores.
«Resulta que sí, al menos en el caso de la nitrogenasa —sentencia Rucker—. Las señales que observamos en el pasado antiguo son las mismas que vemos hoy, lo que también nos dice mucho más sobre la propia enzima».
Pero el hallazgo va más allá de confirmar interpretaciones previas. También sugiere que la nitrogenasa dependiente del molibdeno —la forma más común hoy— surgió muy temprano en la historia de la vida, quizá antes de lo que permiten ver los registros geológicos conservados. Durante mucho tiempo se pensó que la escasez de molibdeno en los océanos primitivos habría limitado este tipo de enzima, favoreciendo otras variantes menos eficientes basadas en hierro o vanadio.
Sin embargo, la estabilidad isotópica observada apunta a un escenario distinto: la nitrogenasa de molibdeno habría estado activa desde fases muy tempranas, dejando una señal persistente que atravesó grandes cambios ambientales, incluida la Gran Oxidación de la atmósfera.
Cuando la vida encuentra una buena solución química, se aferra a ella
Ese detalle es crucial. La Tierra de hace más de dos mil millones de años no solo tenía menos oxígeno; era un planeta químicamente distinto, con océanos ricos en hierro disuelto y ecosistemas microbianos muy simples.
Aun así, la firma isotópica del nitrógeno fijado por la vida parece haber permanecido inalterada. Según los autores, esto indica que los mecanismos bioquímicos fundamentales de la nitrogenasa quedaron fijados muy pronto y se mantuvieron estables, independientemente de los vaivenes ambientales posteriores.
La idea encaja con un patrón más amplio observado en otros ciclos biogeoquímicos, como el del azufre: una vez que un metabolismo eficaz se integra en la biosfera, tiende a persistir sin grandes cambios durante escalas de tiempo geológicas. En palabras implícitas del estudio, cuando la vida encuentra una buena solución química, se aferra a ella.
Holly Rucker, doctoranda en el laboratorio de Betül Kaçar, trabaja con una muestra del microbio fijador de nitrógeno Azotobacter vinelandii, utilizado para estudiar el funcionamiento de enzimas ancestrales en organismos actuales. Cortesía: UW–Madison
Del origen de la vida a la búsqueda de vida extraterrestre
Las implicaciones se extienden más allá de la historia terrestre. Uno de los grandes desafíos de la astrobiología es identificar biosignaturas fiables, esto es, señales químicas o físicas que indiquen la presencia de vida en otros planetas. El nitrógeno, presente en muchas atmósferas planetarias, es un candidato prometedor.
Si la fijación biológica del nitrógeno produce una firma isotópica robusta y estable, como sugiere este trabajo, entonces podría convertirse en una herramienta poderosa para detectar vida pasada o presente en mundos como Marte o exoplanetas rocosos.
Eso no significa que la tarea sea sencilla. Las rocas registran el resultado integrado de múltiples procesos, y no todos los fraccionamientos isotópicos del nitrógeno son biológicos. Pero el hecho de que la señal de la nitrogenasa sea tan persistente refuerza la confianza en su interpretación, siempre que se pueda aislar de otras influencias.
Entender mejor nuestro propio pasado
En el fondo, el estudio propone una nueva forma de mirar al pasado: no solo a través de las rocas, sino también resucitando, de manera controlada, las moléculas que hicieron posible la vida temprana. La combinación de evolución molecular, biología sintética y geoquímica abre una ventana inédita a los primeros capítulos de la biosfera.
«Como astrobiólogos, dependemos de comprender nuestro propio planeta para entender la vida en el universo —subraya Kaçar. Y concluye—: La búsqueda de vida comienza aquí, en casa, y nuestro hogar tiene 4.000 millones de años. Por eso necesitamos entender nuestro propio pasado. Necesitamos comprender la vida que nos precedió si queremos entender la vida que vendrá y la vida en otros lugares».
Resucitar una enzima no devuelve la Tierra primitiva, pero permite probar hipótesis que hasta ahora eran casi filosóficas. ¿Eran los metabolismos antiguos radicalmente distintos? ¿O la vida, una vez arrancada, se movió dentro de márgenes sorprendentemente estrechos? En el caso del nitrógeno, la respuesta parece clara: la vida aprendió pronto a domesticar el aire… y no ha cambiado de método desde entonces.▪️(23-enero-2026)
Información facilitada por la University of Wisconsin–Madison
Fuente: Rucker, H. R., Bubphamanee, K., Harris, D. F. et al. Resurrected nitrogenases recapitulate canonical N-isotope biosignatures over two billion years. Nature Communications (2026). DOI: https://doi.org/10.1038/s41467-025-67423-y